
Acerca de la Revista
Año: 2023
Volumen: 136
Editorial: AMA
TEMAS:
1) Nota de Tapa: Hospital Neuropsiquiátricoal Dr. Braulio Aurelio Moyano | Prof Dra Inés Bores - Prof Dra Amalia Bores
2) Nota Societaria: 75° Aniversario del primer premio nobel en ciencias, Bernardo Houssay | Prof. Dr. Ricardo Jorge Losardo
3) Artículo Original: Controversias en el uso de la vitamina D como preventivo de la esclerosis múltiple. Revisión de la literatura | Dres Elaine Melo Tegani, Robert Wender, Joaquim Pedro De Almeida Soares Neto, Wender Braulio Robert De Matos da Silva, Agnette Tegneby, Carolina Belén Leiva Alza, Miguel Ángel Pagano, Belisario Enrique Fernández
4) Aporte Original: Telmisartán y losartán: las marcadas diferencias entre sus propiedades químicas y farmacológicas pueden explicar la diferencia en la eficacia terapéutica en pacientes hospitalizados con covid-19 | Dres Rodolfo Pedro Rothlin, Facundo Germán Pelorosso, Mariano Duarte, Liliana Nicolosi, Ignacio Eloy Fernandez Criado, María Victoria Salgado, Héctor Vetulli
5) Actualización: Confundibilidad marcaria en los productos farmacéuticos | Dra Mariela Borgarello
6) Historia de la Medicina: Los presidentes médicos de la Sociedad Científica Argentina en sus 150 años | Dres Ricardo Jorge Losardo, Ángel Alonso
Descargar Revista Completa: Rev-1-2023_Completa.pdf
Ver Revista Completa: Rev-1-2023_Completa.pdf
Contenido
Descargar Contenido
Hospital Neuropsiquiátricoal Dr. Braulio Aurelio Moyano
(1906 – 1959)
Asociación Médica Argentina

El Hospital Neuropsiquiátrico Dr. Braulio Aurelio Moyano es un establecimiento para el tratamiento de la salud mental , con internación, dedicado exclusivamente a la atención de mujeres adultas. Está localizado en el barrio de Barracas de la Ciudad de Buenos Aires, en la calle Brandsen 2570 y pertenece al sistema de salud público y de calidad de la ciudad Con el nombre de Hospital Nacional de Alienadas, funcionó en terrenos de la Convalecencia (antiguas posesiones de los jesuitas, que fueron abandonadas al ser expulsados de las colonias por el Rey Carlos III de España, en 1767).
Ante el aumento de la demanda de internación, se decidió la creación de una Comisión Filantrópica, integrada por el Dr. Ventura Bosch y los señores Mariano Miró y Felipe Botet, que donó a la Sociedad de Beneficencia los terrenos de la Convalecencia, a los efectos de edificar un hospital para mujeres con enfermedades mentales. Se destaca el accionar de la Señora Tomasa Vélez Sarsfield en esta gestión. Se habilitó en 1854, habiéndose fraccionado unas parcelas para un hospital para alienados de sexo masculino. El primer director del Hospital Nacional de Alienadas fue el Dr. Ventura Bosch, fallecido en la epidemia de fiebre amarilla en 1871, y sucedido por el Dr. Osvaldo Eguía. La institución cumple con los objetivos de asistir, proteger y rehabilitar a mujeres que padecen trastornos mentales. La actuación de equipos interdisciplinarios otorga a las pacientes atención en las esferas médicas, psicológica y social.
Destacado en la investigación y la docencia, reflejó los adelantos que contribuyeron al progreso de la especialidad; la escuela organicista liderada por el Dr. Christofredo Jakob (1866-1956), médico alemán y director del Laboratorio de Anatomía Patológica de la institución, realizó aportes originales. El advenimiento de la psicoterapia a finales del siglo XX y la incursión de la psicofarmacología en el arsenal terapéutico permitieron disminuir el número de internaciones, calmando cuadros de excitación y delirios. La aplicación de tests para investigar la inteligencia y la personalidad, así como estudios de imágenes y de laboratorio, facilitaron los diagnósticos. Desde 1992 depende del Gobierno de la Ciudad Autónoma de Buenos Aires. Su guardia atiende todos los días durante las 24 horas. Tiene servicio clínico-quirúrgico y de distintas especialidades. Se destaca el Departamento de Docencia e Investigación por la realización de trabajos científicos con aportes originales, ateneos, jornadas y cursos de posgrado, además de la carrera de médico especialista en Psiquiatría, reconocida por su excelencia. Dentro del mismo Hospital se encuentra un bachillerato con orientación de salud, el Centro Educativo de Nivel Secundario Nº 49.

La institución rinde homenaje al destacado médico neurobiólogo Dr. Braulio Aurelio Moyano (San Luis, 21 agosto de 1906 - Buenos Aires, 7 de julio 1959), cuyas investigaciones le otorgaron prestigio internacional. Fue discípulo del Dr. Jakob, dominando el estudio anátomopatológico del sistema nervioso. En 1935, junto con Roque Orlando, describió la patogenia del Signo de Argyll Robertson (abolición del reflejo fotomotor [contracción de pupilas a la luz], conservando el reflejo de la acomodación descrito en 1869). Demostraron que la desmielinización de las fibras nerviosas que inervan el iris es la causante de su contracción, (etiología: neurosífilis, diabetes mellitus, lupus sistémico, encefalopatía de Gayet-Wernicke). Estudió en colaboración con Gonzalo Bosch los beneficios aportados por la malarioterapia en la parálisis general progresiva, adjudicándolos a la hipertrofia de la microglia, en coincidencia con otros autores.
Su tesis versó sobre las demencias preseniles y seniles. Se destacó una monografía sobre la enfermedad de Pick y su relación con la afasia sensorial de Wernicke. Autor de numerosos trabajos científicos, su obra “Anatomía Patológica de las Enfermedades Mentales” (1944) fue distinguida con el Premio Nacional de Ciencias Aplicadas a la Medicina Vivió en el Hospital Nacional de Alienadas, que fue designado con su nombre.
Prof Dra Inés Bores Ex presidente de la Sociedad Argentina de Historia de la Medicina, AMA.
Prof Dra Amalia Bores Ex presidente de la Sociedad Argentina de Historia de la Medicina, AMA.
Correo electrónico: inesbores1@gmail.com
Descargar Contenido
NOTICIA SOCIETARIA
75° Aniversario del primer premio nobel en ciencias, Bernardo Houssay
Por el Prof. Dr. Ricardo Jorge Losardo

El día viernes 16 de diciembre de 2022, a las 18 h, se realizó una Sesión Pública Solemne en la Asociación Médica Argentina, en conmemoración del 130° aniversario de la AMA y el 75° aniversario del primer premio nobel en Ciencias, Bernardo Houssay. En el Salón Mariano Castex, se inició el cronograma de actividades con el Dr. Miguel Galmés, presidente de la institución, quien disertó sobre el 130° aniversario de la AMA.
A continuación, el Dr. Ricardo Losardo hizo una presentación del 75° aniversario del Premio Nobel otorgado al Dr. Bernardo Houssay. Luego, el Dr. Leopoldo Houssay expuso acerca de los aspectos biográficos y personales del premio nobel y, finalmente, Losardo disertó sobre Houssay y su actuación en la AMA.
Luego se dirigieron al salón exposición en el subsuelo de la AMA, donde el Dr. César Gotta realizó una presentación fotográfica de la vida del premio nobel, en colaboración con el Dr. Afredo Buzzi y la curadora Micaela Patania. Para finalizar la Sesión Pública Solemne, se realizó un vino de honor, estrechando la confraternidad de los asistentes.
Estuvieron presentes las siguientes instituciones: Academia Nacional de Ciencias de Buenos Aires, Asociación Argentina para el Progreso de las Ciencias, Sociedad Científica Argentina, Asociación de Médicos Municipales de la Ciudad de Buenos Aires, Casa Museo Dr. Bernardo Houssay, Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Instituto de Biología y Medicina Experimental (IByME), Rotary Club de La Plata, Sociedad Argentina de Biología, Sociedad Argentina de Ecografía General y Ultrasonografía, Sociedad Argentina de Historia de la Medicina, Sociedad Argentina de Mastología, Sociedad Argentina de Medicina del Trabajo y Salud Ocupacional, Sociedad Argentina de Medicina Interna de Buenos Aires, Sociedad Argentina de Mujeres Médicas, Sociedad Argentina de Neumonología, Sociedad Argentina de Obesidad y Trastornos Alimentarios, Sociedad Argentina de Psicología Médica, Psicoanálisis y Medicina Psicosomática, Sociedad Argentina de Salud y Espiritualidad, Comité de Auditoría Oncológica, Comité de Ginecología y Obstetricia, Comité de Psicooncología y Comité de Salud Integral de la Adolescencia, entre otros.




Descargar Contenido
ARTÍCULO ORIGINAL
Controversias en el uso de la vitamina D como preventivo de la esclerosis múltiple. Revisión de la literatura
Dres Elaine Melo Tegani,1 Robert Wender,1 Joaquim Pedro De Almeida Soares Neto,1 Wender Braulio Robert De Matos da Silva,1 Agnette Tegneby,1 Carolina Belén Leiva Alza,2 Miguel Angel Pagano,3 Belisario Enrique Fernández4
1 Médico. 2 Técnica en Análisis Clínicos, Diplomada en Didáctica y Pedagogía de Ciencias de la Salud. 3 Doctor en Medicina, Especialista en Neurología. 4 Doctor en Medicina, Especialista en Medicina del Trabajo. Instituto Universitario de Ciencias de la Salud de la Fundación Barceló. Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
La esclerosis múltiple (EM) es una enfermedad desmielinizante que afecta el sistema nervioso central. A pesar de los avances en materia de diagnóstico y tratamiento, se desconocen aún muchos aspectos de su etiopatogenia y fisiopatología. La EM es una de las principales causas de discapacidad neurológica y, por los elevados costos de los tratamientos inmunomoduladores e inmunosupresores, tiene un gran impacto económico en la salud pública. Por ello, se intentaron diversos tratamientos preventivos, como la utilización de la vitamina D. Debido a la acción de la vitamina D sobre el sistema inmune, ha sido prescripta en sujetos de riesgo. Sin embargo, hasta el momento actual, los estudios sobre sus efectos no resultaron concluyentes y persisten las dudas acerca de sus posibles beneficios en materia de prevención. El objetivo de la presente revisión bibliográfica es realizar una puesta al día y destacar los aspectos controversiales en relación al uso de la vitamina D como tratamiento preventivo de la esclerosis múltiple.
Palabras claves. Vitamina D, esclerosis múltiple, desmielinización, autoinmunidad, inmunosupresión.
Controversies in the Use of Vitamin D as a Preventive of Multiple Sclerosis. Literature Review
Summary
Multiple sclerosis (MS) is a demyelinating disease that affects the central nervous system. Despite advances in diagnosis and treatment, many aspects of its etiopathogenesis and pathophysiology remain unknown. MS is one of the main causes of neurological disability and, due to the high costs of modern immunomodulatory and immunosuppressive treatments, it has a great economic impact on public health. Therefore, numerous efforts have been made in the search for preventive treatments. For this reason, various preventive treatments were tried, such as the use of vitamin D. Due to its action on the immune system, it has been used in subjects at ME risk. However, these studies have been inconclusive to date, and its possible benefits in terms of prevention are still being questioned. The objective of this bibliographic review is to update and highlight the controversial aspects in relation to the use of vitamin D as a preventive treatment of multiple sclerosis.
Keywords. Vitamin D, multiple sclerosis, demyelination, autoimmunity, immunosuppression.
Abreviaturas
25 (OH)D: 25-hidroxivitaminaD.
25-OH-D3: 25-hidroxivitaminaD3.
7DHC: 7- dehidrocolesterol.
CD: Células dendríticas.
CPA: Células presentadoras de antígenos.
CT: Células T.
EM: Esclerosis múltiple.
HLA: Antígenos leucocitarios humanos.
HV: Virus de herpes.
LB: Linfocitos B.
LT: Linfocitos T.
MHCI: Mayor de histocompatibilidad de clase I.
ODC: Pérdida de oligodendrocitos.
SNC: Sistema nervioso central.
TCR: T cell receptor.
UV: Rayos ultravioleta.
VD3: Vitamina D3.
VD: Vitamina D.
VDBP:
Vitamin D bindingprotein.
Introducción
La EM es una enfermedad del SNC de alto impacto, dado que afecta preferentemente población joven y produce distintos grados de invalidez. Las evidencias actuales indican que subyace una patogenia autoinmune que genera la producción de un proceso inflamatorio crónico, con infiltrados linfocitarios en encéfalo y médula espinal. Afecta primordialmente la mielina del SNC y también los componentes axonales en estadios avanzados.1 Alrededor de 2 millones de personas en el mundo presentan EM, siendo la enfermedad neurológica desmielinizante del SNC más común en adultos jóvenes (20-40 años), con mayor prevalencia en mujeres (proporción 2:1).2 Origina altos costos (se estiman gastos de 1.200 millones de euros al año), destinados principalmente a subsanar las dificultades de la discapacidad. Lo destinado a los tratamientos específicos, si bien éstos son muy costosos, no supone más del 16 al 18% del gasto total, unos 200 millones de euros al año aproximadamente.3
Los síntomas de la EM dependen de la zona del cerebro lesionada. Podemos encontrar, entre otros: alteraciones de la sensibilidad, como parestesias referidas como descargas eléctricas, trastornos del equilibrio y compromiso esfinteriano.4 Los síndromes más frecuentes en la forma a brotes y remisiones de la EM son: neuritis óptica, mielitis transversa, oftalmoplejía internuclear, síndrome piramidal, síndrome cerebeloso, neuralgia del trigémino, espasmo hemifacial y síndromes polisintomáticos.5 Las discapacidades son consecuencia de la progresión de la enfermedad, en la que las remisiones tienden a ser incompletas, provocando un impacto negativo en la calidad de vida de los pacientes.6 Actualmente, aunque ni la etiología ni la fisiopatogenia de la EM están completamente dilucidadas, se conoce que el proceso básico de la enfermedad reside en la autoinmunidad. Se observa un trasfondo de predisposición genética en el que tiene un papel primordial el sistema HLA, modificado por factores epigenéticos (metilación de genes) y ambientales, como las infecciones víricas, especialmente por el HV. En el curso de la infección vírica primaria, el HV infecta las células del SNC, y puede permanecer en fase latente, para posteriormente reactivarse. Otros factores que también estarían relacionados son: el tabaquismo, la deficiencia de vitamina D y la influencia de las hormonas sexuales.7 El déficit de VD puede influir en la patogénesis de la EM. Entre los factores que favorecen la hipovitaminosis, se encuentran la asociación con la baja exposición solar y los bajos niveles séricos de VD, contribuyendo con cierta susceptibilidad a la enfermedad, posiblemente al dificultar la trasmisión nerviosa entre el cerebro y otras partes del cuerpo.8
La luz solar es necesaria para la activación de la VD, pero en algunos lugares del planeta la exposición a la luz solar es menor, coincidiendo con un índice de prevalencia más alto de la EM. Si bien la prevalencia de esta enfermedad parece aumentar en los países más alejados del Ecuador,9 la incidencia de la EM es cada vez mayor en la América Latina; esto podría relacionarse con el hecho de que el cuerpo humano requiere, para sintetizar la VD, la exposición al sol a “piel descubierta”. Ocurre que la luz solar filtrada a través de una ventana, las nubes, la niebla contaminada (esmog) y la piel de color oscuro, reducen la cantidad de VD producida por la piel.10 Se ha planteado la hipótesis de que el aumento de la incidencia de la EM en estas regiones podría relacionarse con este déficit en la síntesis de VD. Habida cuenta de los elevados costos ocasionados por la EM y dada la complejidad de los procedimientos de diagnóstico y tratamiento, con el consiguiente impacto en países cuyos sistemas de salud están en desarrollo, es importante analizar la existencia de factores preventivos de la EM, como podría ser de la deficiencia de la VD.
Autoinmunidad en la Esclerosis Múltiple
La autoinmunidad de la EM, según CuevasGarcia11 está ligada a las CT que reconocen específicamente fragmentos de mielina del propio organismo como autoantígenos capaces de inducir una respuesta inmunológica e inflamatoria, originando daño tisular agudo y contribuyendo así al desarrollo de lesiones en el SNC, disrupción de la barrera hematoencefálica, inflamación, desmielinización, ODC, gliosis reactiva y degeneración neuronal/axonal, que es la causa más importante de discapacidad neurológica. La EM es inducida por un efecto secundario no esperado de la respuesta inmunitaria sistémica contra antígenos extraños “no propios” debido al mimetismo molecular, que sugiere que antígenos no propios, presentan homología estructural con antígenos propios, induciendo la autoinmunidad del SNC. Las CT, mediante receptores duales TCR, pueden reconocer a un antígeno no propio y de manera errónea a un antígeno propio, por el segundo receptor TCR. La unión de un autoantígeno a este segundo receptor desencadenaría la respuesta autoinmune, como sucedería en la EM, hipótesis para la autoinmunidad en la patogénesis de la EM.11 Se considera que el aporte de las células B en la EM se produce a través de la producción de citocinas proinflamatorias, como la linfotoxina y el TNFα, y su capacidad de actuar en las células presentadoras de antígenos para activar a las células T. En el epicentro de la respuesta inmune de la EM se encuentra el componente de las células TCD4+, que comprende al Th1 y Th17, responsable de promover la activación de células de la microglía, macrófagos y astrocitos, mediante la producción de citocinas (IL-12) y factores de crecimiento, procesos que actuando en conjunto activan los mecanismos adicionales neurodegenerativos.12
Las células TCD8+ también están involucradas en la EM, porque inducen la muerte neuronal, interactuando con células que expresan el complejo MHCI, que se manifiesta en células nucleadas, formando una sinapsis inmunológica estabilizada por moléculas de adhesiones LFA-1 e ICAM-1, involucradas en la destrucción de las neuronas por parte de las TCD8+. Es importante considerar que estas células además producen grandes cantidades de TNFα e IFNy. El TNFα altera directamente la estructura y funcionalidad de la membrana neuronal, interfiriendo en la funcionalidad de las neuronas e induciendo su apoptosis. El IFNy modula la actividad del receptor AMPA GluR1, incrementando la muerte neuronal por excitotoxicidad y produciendo IL17 que también participa en la patogenia de la EM.11,13
Hipovitaminosis D en la Esclerosis Múltiple
La VD es un esteroide que se encuentra inactivo en el organismo, debiendo ser activada para ser funcional. Es producida de manera endógena por efectos de la radiación ultravioleta en la piel o está disponible a partir de fuentes alimenticias exógenas o suplementos dietéticos. La piel es la principal fuente natural de síntesis de la VD y la exposición a los rayos UV de la luz solar, convierten al 7DHC en previtamina D3 y posteriormente en VD3) que, para ejercer sus funciones biológicas, debe primero activarse metabólicamente mediante un proceso por el cual la VD3 unida a una proteína transportadora conocida como VDBP es transportada hasta el hígado, donde es hidroxilada por la acción de la enzima hidroxilasa CYP2R1, formando 25-OH-D3, que es la forma circulante. Posteriormente en el túbulo contorneado proximal del riñón, por la acción de la enzima 1α-hidroxilasa, es convertida en la forma activa, que es el metabolito con características hormonales 1 alfa, 25-dihidroxivitamina-D3 (1,25 - (OH)2D3), calcitriol o VD3.14 La concentración sérica de 25 (OH)D, el principal metabolito circulante de la VD, es el mejor indicador de su estado, ya que tiene una vida media bastante larga de 15 días y refleja tanto la síntesis cutánea, como la ingesta dietética de alimentos y suplementos. Por el contrario, la 1,25 (OH) 2D no se considera un buen marcador, pues tiene una vida media corta de 15 horas. Actualmente no existe un consenso mundial sobre el estado óptimo de la VD; los niveles séricos de 25 (OH)D ≥ 75nmol/L (≥ 30µg/mL) se consideran adecuados para la salud en general, mientras que los niveles entre 50 y 75 nmol/L (20-30µg/mL) indican “insuficiencia”, y los niveles < 50nmol/L (< 20µg/mL) deficiencia.15
Existe una marcada correlación entre áreas geográficas, hipovitaminosis D y alta prevalencia de EM. En Suecia, país con alta prevalencia de EM, se observó que los niveles séricos de VD eran 4 veces más elevados durante el verano que en el invierno. En Suiza se registró que los pacientes con EM sufrían una fluctuación estacional de las manifestaciones de la enfermedad, con más recaídas durante el invierno y la primavera que durante el verano. En Alemania, observaron que los pacientes con EM tenían más lesiones, realzadas con gadolinio en T1MR1, en primavera y principios de verano y menos enotoño.16-17 Lamentablemente estas observaciones no fueron correlacionadas directamente con las concentraciones séricas de 25 (OH)D, el metabolito de la VD que mejor refleja su estado.18 La hipótesis que sugiere que la prevalencia e incidencia crecientes de la EM basada en la teoría de la exposición a la luz solar va perdiendo sustentación, especialmente en los EE.UU, en donde los niveles más altos de VD pueden ser atribuidas a su mayor ingesta en la dieta.19
Esta afirmación es respaldada por la observación de que el mayor consumo de pescado rico en VD en pueblos costeros de Noruega parece correlacionarse con la menor prevalencia de EM, en comparación con los pueblos del interior con latitudes similares.20 La hipótesis que relaciona la prevalencia de la EM con la alimentación también se planteó en un estudio transversal realizado en mujeres mayores de 20 años. Se determinó la 25 (OH)D mediante electroquimioluminiscencia y considerando una concentración sérica de ≤ 30ng/ml para definir la deficiencia de VD. Se registró el consumo de alimentos naturales como pescado y huevo, y los enriquecidos en VD, como la leche. No se cuantificó el aporte de las radiaciones UV, aunque hubo homogeneidad en relación a la raza mestiza y el estudio que se realizó en invierno. Los resultados mostraron que el promedio de consumo de VD fue 3 µg/día, por debajo del consumo recomendado de 10 µg/día, poniendo en evidencia que la dieta solamente no sería suficiente para alcanzar los niveles óptimos de VD.21
González et al.22 señalan que el déficit de vitamina D favorece el desarrollo de EM, recomendando su suplementación; también resaltan que para tener influencia real en la evolución de la EM, la hipovitaminosis D debería estar presente antes del inicio de las manifestaciones de la enfermedad, de manera que si se mantienen niveles de VD normales en las etapas precoces de la vida, el riesgo de contraer EM disminuiría. El monitoreo y la prescripción de suplementos de VD deben efectuarse desde la niñez, enfatizando el valor de la dieta, pues la alta prevalencia de niños sanos con insuficiencia de VD podría deberse a la deficiencia en alimentos ricos en VD, por la menor exposición solar y por el uso de fotoprotectores.23 La suplementación con VD podría disminuir el riesgo de EM en la población en general y también en hijos de madres suplementadas antes y durante el embarazo. En Finlandia, se registraron los niveles séricos de VD en mujeres embarazadas sanas y con EM, demostrándose que las pacientes con EM tenían niveles más bajos de 25 (OH) D3 durante todo el embarazo en comparación con controles sanos.24
Rol de la vitamina D en el Sistema Inmunitario
La VD modula la respuesta inmune, interactuando con el receptor expresado en las CPA, como CD y en macrófagos y LB y LT. Además, la enzima α-1hidroxilasa se expresa en la mayoría de estas células productoras de 1,25 (OH)2D que posee efectos autocrinos y paracrinos en la modulación de las respuestas inmunitarias.25 La VD puede regular los LT directa e indirectamente a través de la modulación de las CPA. Al inhibir la maduración de las CD, reduce la producción de IL-12, cuya acción es crítica para la maduración del linfocito Th1. La VD3 reprime la transcripción de los genes que codifican la IL-12 e IFNy, citoquinas que definen el perfil de linfocitos Th1. La VD3 se une al receptor e inhibe la transcripción del factor NF-AT que es un activador del promotor de los genes que codifican la IL-2.26 Otra función importante de la VD, es la regulación de la apoptosis y las señales de muerte celular (Fas-FasL), importantes para el mantenimiento de la homeostasis de los LT y para la regulación de la respuesta inmune. A través de este proceso se elimina los LT autorreactivos, desarrollando tolerancia a los propios antígenos, contribuyendo a la adquisición del estado de tolerancia periférica. Las alteraciones en este sistema contribuyen, entonces, a la aparición de enfermedades autoinmunes.27
Controversias sobre el uso beneficioso de la Vitamina como agente preventivo y terapéutico en la esclerosis múltiple
La deficiencia de VD está relacionada al desarrollo y la gravedad de la EM. La administración de VD parece atenuar los síntomas de la enfermedad y prevenir su progresión.28 La VD, que comparte su estructura química con los esteroides, podría mantener la función cognitiva y prevenir una demencia prematura, existiendo evidencias de que la deficiencia de VD se correlaciona con la atrofia cerebral en el hipocampo.29 La VD es considerada un neuroesteroide con influencia importante sobre las neuropatías. Martínez Pizarro30 resalta que su presencia en el SNC actúa regulando funciones como la excitotoxicidad mediada por calcio, la reducción del estrés oxidativo, la inducción de proteínas estructurales sinápticas y de factores neurotróficos y la disminución de transmisores defectuosos. La forma más activa de la VD es el 1,25 (OH)2D3 (calcitriol), implicada en el desarrollo y la funcionalidad cerebral en humanos. Sus efectos biológicos se traducen por medio de la activación de su receptor nuclear (VDR), que actúa como un factor transcripcional, regulando la expresión de genes. Está localizado y ampliamente distribuido en el SNC.31
Se conoce poco sobre cómo actúa la VD durante el proceso de mielinización; existen estudios que indican un potencial papel beneficioso de la VD en la mielinización y la remielinización y muestran los efectos que tendría sobre las histonas, favoreciendo la remielinización de las lesiones desmielinizadas. Dado que la VD disminuye la expresión de la sintasa del ácido nítrico inducible en la microglía, podría influir en el equilibrio inflamatorio-antiinflamatorio, facilitando la eliminación de los restos de mielina y la remielinización.32 La administración de VD promueve la proliferación de células madre de origen neural que expresan VDR y aumentan la diferenciación a neuronas y ODC, mejorando la formación de mielina in vitro.33 Considerando que los tratamientos para la EM están centrados en el carácter inmunológico de la enfermedad, Mansur et al.34 reportaron que el suplemento con altas dosis de VD (para alcanzar valores séricos de 38 µg/mL) es apropiado para mejorar el sistema inmunitario y disminuir el riesgo de infecciones. Otros autores sugieren mantener un nivel de VD óptimo en un rango entre 40 y 60 µg/mL para obtener una acción antiinflamatoria. La suplementación con altas dosis de VD, de 10.000 UI/diarias durante 6 meses a pacientes oncológicos, permitió alcanzar valores de VD del orden de los 78,6 ± 13 µg/mL, sin provocar hipercalcemia.35
Mientras muchas investigaciones avalan el uso de la VD como prevención y tratamiento de la EM, otras ponen en duda su acción beneficiosa. Se postuló que el uso de muy altas dosis de VD en pacientes con EM, como las utilizadas en el protocolo de “Coímbra” (400.000 UI/día), es riesgosa, y se podría exacerbar la enfermedad. Iacopetta et al.36 reportaron que todavía no está demostrado que el déficit de VD contribuya a la aparición de trastornos neurológicos y su déficit es solamente un síntoma de la enfermedad. En un análisis de bases de datos sobre el uso de la VD en enfermedades neurodegenerativas, se observó la ausencia de evidencias suficientes para afirmar rotundamente que la VD tenga un papel neuroprotector, sugiriendo que este rol dependía más de la vía de administración de la vitamina. La mayoría de los trabajos que respaldan los efectos neuroprotectores de la VD se basan en estudios preclínicos y observacionales, pero faltan pruebas sólidas que respalden la hipótesis de que la exposición a los rayos UV que aumenta la síntesis de VD endógena es realmente beneficiosa en la EM, si bien consideran que la exposición al sol, independientemente de la producción de vitamina D, podría proteger contra la EM, las enfermedades de Parkinson y Alzheimer. No está claro si la VD protege contra la neurodegeneración, o si es un marcador asociado a la exposición a los rayos UV que puede contribuir a factores neuroprotectores aún no identificados. Makkawi et al.37 no encontraron asociación entre los niveles de VD y las recaídas en pacientes con EM, si bien las mismas predominaron en invierno, estación que coincide con niveles más bajos de la VD. En revisiones de bases de datos, tampoco se encontraron evidencias que la VD sea beneficiosa para la prevención de enfermedades neurodegenerativas como la EM,38 mostrándose solamente evidencias marginales sobre el uso de la VD en la EM, no identificándose los riesgos asociados a la anafilaxia; no se recomienda entonces el uso generalizado de la VD pues la falta de evidencias no respalda su uso profiláctico. Se señala que son necesarios más ensayos controlados basados en evidencias comprobables.39-40
Conclusión
La revisión sistemática de la literatura disponible en bases bibliográficas como Scielo y Pubmed, permitió analizar el contexto de la acción de la vitamina D en la EM. Considerando a la EM como una enfermedad autoinmune, la VD podría ser beneficiosa para evitar su progresión, pues actúa inhibiendo los LT que reconocen fragmentos de mielina, como también sobre la remielinización, dado que la vitamina D disminuye la expresión de la sintasa del ácido nítrico inducible en la microglía, influenciando la remielinización. Sin embargo, existen publicaciones en las que se pone en duda la eficacia de la VD para la prevención y terapéutica en al EM. De acuerdo con los datos recolectados, es necesario proseguir las investigaciones sobre el rol que desempeña la VD en la EM para poder discriminar con seguridad si la vitamina sería capaz de prevenirla o atenuar su progresión y en qué dosis debería prescribirse para alcanzar los objetivos sin llegar a sobredosis que perjudiquen al paciente.
Propiedad intelectual. Elaine Melo Tegani, Robert Wender, Joaquim Pedro De Almeida Soares Neto, Wender Braulio Robert De Matos da Silva y Agnette Tegneby participaron en la búsqueda bibliográfica, el relevamiento de datos y la elaboración del manuscrito; Carolina Belén Leiva Alza participó en la dirección y la coordinación general del trabajo; Miguel Ángel Pagano colaboró en el asesoramiento general y la corrección del manuscrito, y Belisario Enrique Fernández participó en la dirección general del trabajo, en el asesoramiento y la corrección del manuscrito. El manuscrito ha sido leído y aprobado por todos los autores, que ceden los derechos y autorizan su publicación en la Revista de la Asociación Médica Argentina y se han cumplimentado los requerimientos para la autoría expuestos en la guía de publicaciones de la Revista. Los autores declaran que el contenido del manuscrito no ha sido publicado ni difundido por los mismos con anterioridad.
Financiamiento. Los autores declaran que no hubo fuentes de financiación externas, y que el manuscrito es inédito y no tiene publicaciones parciales del mismo.
Conflicto de interés. Carolina Belén Leiva Alza, en su carácter de autor responsable y en representación de los demás autores declara que ninguno de los mismos mantiene conflictos de interés que afecten la publicación del manuscrito.
Bibliografía
1. López-Méndez P, Sosa Henríquez M. Vitamina D y Esclerosis Múltiple. Prevalencia de Hipovitaminosis D. Rev Osteoporosis y Metabolismo Mineral 2015;7(2):71-78. https://scielo.isciii.es/scielo.php?script =sciarttext&pid=S1889-836X2015000200006
2. Rodenas-Esteves I, Wanden-Berghe C, Sanz-Valero J. Efectos del estado nutricional en la Enfermedad de la Esclerosis Múltiple: revisión sitemática. NutrHosp 2018;35(1):221-223. https://scielo.isciii.es/scielo.php?script=sci_abstract&pid=S0212-16112018000100211
3. Ayuso G. Esclerosis Múltiple: impacto Socioeconómico y en la calidad de vida de los pacientes. Medicina Clínica 2014;143(3):7-12. https://www.sciencedirect.com/science/article/abs/pii/S0025775315300038
4. Pérez C, Lopez; Himara HM, OrtízHolger N, et al. Tasa de Mortalidad de la Esclerosis Multiple en Venezuela según edad y género. GacMéd Caracas 2003;111(3):227- 230. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0367-47622003000300008
5. Vázquez Gómez LA, Hidalgo Mesa C, Broche Pérez Y, et al. Caracterización epidemiológica, clínica e imagenológica de pacientes con esclerosis múltiple. MedicentroEletrónica, Santa Clara 2021;25(3):123- 147. https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1340191
6. Osorio-Marcatinco V.; Castro-Suarez S, Meza-Vega M. Características del estado cognitivo de pacientes conesclerosismúltiple remitente – recurrente durante el brote enel Instituto Nacional de Ciencias Neurológicas 2014-2016. Rev. Neuro-Psiquiatria 2018;81(2):58-64. https://revistas.upch.edu.pe/index.php/RNP/article/view/3331
7. Flores-Alvarado LJ, Ortiz GG, Pacheco FP, et al., Mecanismos patogénicos en el desarrollo de la esclerosis múltiple: ambiente, genes, sistema inmune y estrés oxidativo. Invest clin Maracaibo jun 2015;56(2)201-214. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0535-51332015000200009
8. Datos sobre la vitamina D. NationalInstitute of Health (USA). Office of Dietary Supplements. 2 junio 2022. https://ods.od.nih.gov/pdf/factsheets/VitaminD-DatosEnEspanol.pdf
9. Correa-Díaz, EP, Jácome Sánchez EC, Torres Herrán, GE, et al. El Perfil epidemiológico y Clínico de la Esclerosis Múltiple en el Ecuador. Rev EcuatNeurol 2019;28(2):59- 70. http://scielo.senescyt.gob.ec/scielo.php?script=sci_arttext&pid=S2631-25812019000200059
10. García-Estévez DA, Fraga-González C, Ramos-Pacho ME, et al. Prevalencia de la esclerosis múltiple en la ciudad de Ourense, Galicia, noroeste de la Península Ibérica. RevNeurol 2020;71(01):19-25. https://neurologia. com/articulo/2019432
11. Cuevas Garcia Carlos. EsclerosisMúltiple: Aspecto inmunológicos Actuales. Revista Alergia México 2017;64(1):76-86. https:// www.scielo.org.mx/scielo.php?script=sci_abstract&pid=S2448 -91902017000100076&lng=es&nrm=iso
12. Baldwin RL, Stolowitz, ML, Hood L et al. Structural changes of tumor necrosis alpha associated with membrane insertion and formation. ProcNatlAcadSci USA 1996; 93(3):1021-1026. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC40023/
13. Mizuno T, Zhang G, Takeuchi H et al. Interferon-Gamma directly induces neurotoxicity through a neuron specific, calcium-permeable complex of INF-gamma receptor and AMPA GluR1 receptor. FASEB J. 2008;22(6):1797- 1806. https://pubmed.ncbi.nlm.nih.gov/18198214/
14. Pedreañez Santana AP, Muñoz Castelo NE, TeneSalcan DM, et al. Análisis del papel de la vitamina D en la defensa inmunitaria contra Covid-19 en adultos mayores. Rev virtual SocParag Med Int 2021;8(2):76-88. http://scielo. iics.una.py/scielo.php?script=sci_arttext&pid=S2312-38932021000200076
15. Kim HA, Perreli A, Retta SF et al. Vitamin D Deficiency and the risk of Cerebrovascular Disease. Antioxidants (Basel) 2020;9(4):327-349. https://www.ncbi.nlm.nih. gov/pmc/articles/PMC7222411/
16. Lips P. Vitamin D status and nutrition in Europe and Asia. J Steroid Biochem Mol Biol 2007;103:620-625. https://pubmed.ncbi.nlm.nih.gov/17287117/
17. Simpson S Jr, Bizzard L, Otahal P et al. Latitud is significantly associated with the prevalence of multiple esclerosis: a meta- analysis. J neurolNeurosurg Psychiatry 2011;82:1132- 1141. https://jnnp.bmj.com/content/82/10/1132
18. Smolders J. Vitamin D and Multiple Sclerosis: Correlation, Causality, and Controversy. Autoimmune Dis 2010;2011(629538):1-3. https://www.ncbi.nlm. nih.gov/pmc/articles/PMC3003950/
19. Gandhi F, Jhaveri S, Avanthika C et al. Impact of Vitamin D Supplementation on Multiple Sclerosis. Cureus 2021;13(10):1-10,e18487. https://www.ncbi.nlm.nih. gov/pmc/articles/PMC8567111/
20. PajueloRamirez J, Bernui Leo I, Arbañil Huamán H, et al. Vitamina D y su relación con factores de riesgo metabólicos para enfermedad cardiovascular en mujeres adultas. An. Fac. Med Perú 2018;79(2):119-124. http:// www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1025-55832018000200003
21. Virú Loza MA. Deficiencia de vitamina D asociada a hiperfosfatemia en niños. Acta MedPeru 2021;38(2) :117-122. http://www.scielo.org.pe/scielo.php?pid=S1728 -59172021000200117 &script=sci_arttext&tlng=pt
22. Silva-González O, Roco-Videla A, Maureira-Carsalade N. Vitamina D, cálcio y esclerosis múltiple. Carta al editor. Nutr. Hosp 2022;39(3)705. https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0212-16112022000400026
23. Martínez Redondo I, García Romero R, Calmarza P, et al. Déficit de vitamina D en una población pediátrica sana. La importancia de una adecuada profilaxis. NutrHosp, Madrid 2021;38(6:) 1155-1161. https://scielo.isciii.es/scielo.php? script =sci_arttext&pid=S0212-16112021000700008
24. Jalkanen A, Kauko T, Turpeinen U, et al. Multiple Sclerosis and Vitamin D during pregnancy and lactation. ActaNeurolScand 2015;131(1):64-67. https://pubmed.ncbi.nlm.nih.gov/25216350/
25. Coronato Solari S, LaguensCalabrese G, Di GirolamoMassini VT. Acción de la vitamina D3 en el sistema inmune. Rev. Cubana Hematol Inmunol Hemoter 2005;21(2):1-10. https://www.imbiomed.com.mx/articulo.php?id=33968
26. Hewison M, Freeman L, Hughes S, et al. Differential regulation of vitamin D receptor and its ligand in human monocyte-derived dendritic cells. J Immunol 2003;170(11):5382-5390. https://pubmed.ncbi.nlm. nih.gov/12759412/
27. Cippitelli M, Fionda C, Di Bona D, et al. Negative regulation of CD95 ligand gene expresión by vitamin D3 in T Lymphocytes. J Immunol 2002;168(3):1154-1166. https://pubmed.ncbi.nlm.nih.gov/11801650/
28. De Menezes A M, Dos Santos E C, Otoni GC, et al. La importancia de mantener los niveles de vitamina D para el sistema inmunológico. Research, Society and Development 2021;10(12) e284101220453. https://rsdjournal.org/index.php/rsd/article/download/20453/18237/248192.
29. Goischke HK. Comorbidities in multiple sclerosis-a plea for interdisciplinary collaboration to improve the quality of life of MS patients. Degener Neurol Neuromuscul Dis. 2019;13(9):39-53. https://pubmed.ncbi.nlm.nih. gov/31354380/
30. Martínez Pizarro, S. Papel de la Vitamina D en las Enfermedades Neurológicas. Sanum. España 2020;4(1):6-1. https://revistacientificasanum.com/articulo.php?id=79
31. Talavera Hernandez, C, Flores-Aldana, M, Macías Morales N, et al. Vitamina D y Esclerosis Múltiple: Evidencia científica. NeurolArg 2013;5(4):250-258. https://www.elsevier.es/es-revista-neurologia-argentina-301-articulo-vitamina-desclerosis-multiple-evidencia-S1853002813001110
32. Guiu, J.M; Pinedo, U. G; Oreja-Guevara, C; Guíu, J.A. Vitamina D y remielinización en la esclerosis múltiple. Neurología 2018;33(3):177-186. https:// www.sciencedirect.com/science/article/pii/S0213485316300652
33. AtashiShirazi H, Rasouli J, Ciric B, et al. 1,25-Dihydroxyvitamin D3 enhances neural stem cell proliferation and oligodendrocyte differentiation. ExpMolPathol. 2015;98(2)240-245. https://pubmed.ncbi.nlm.nih.gov/25681066/
34. Mansur J.L, Tajer C, Mariani J et al. El suplemento con altas dosis de vitamina D podría representar una alternativa promisoria para prevenir o tratar la infección por covid-19. Clin. InvestigArterioescler. 2020;32(6):267-277. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7256522/
35. González Albert E. Remielinizacion y Esclerosis Múltiple. Nuevo abordaje Farmacoterapéutico. Revisión bibliográfica. Fac. Farmacia. Sant Joan d´Alacant, España. Ed Universitas Miguel Hernández 2019;1-26. https:// hdl.handle.net/11000/6905
36. Iacopetta K, Collins-Praino LE, Buisman-Pijlman FTA et al. Are the protective benefits of vitamin D in neurodegenerative disease dependent on route of administration? A systematic review. Nutr Neurosci. 2020;23(4):251- 280. https://pubmed.ncbi.nlm.nih.gov/29985117/
37. Makkawi S, Aljabri A, Bin Lajdam G, et al. Effect of Seasonal Variation on Relapse Rate in Patients With Relapsing-Remitting Multiple Sclerosis in Saudi Arabia. Front Neurol. 2022;14(13):1-7. Art 862120 (e-collection). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8964008/
38. Maretzke F, Bechthold A, Egert S, et al. Role of Vitamin D in Preventing and Treating Selected Extraskeletal DiseasesAn Umbrella Review. J. Nutrients. 2020;12(4):969(1-36). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7231149/pdf/nutrients-12-00969.pdf.
39. Namaka M, Crook A, Doupe A, et al. Examining the evidence: complementary adjunctive therapies for multiple sclerosis. NeurolRes. 2008;30(7):710-719. https:// pubmed.ncbi.nlm.nih.gov/18631428/
40. Miclea A, Bagnoud M, Chan A, et al. A Brief Review of the Effects of Vitamin D on Multiple Sclerosis. Front. Immunol, 2020;11:art781:1-10.eCollection2020. https://www.frontiersin.org/articles/10.3389/fimmu.2020.00781/full
Descargar Contenido
APORTE ORIGINAL
Telmisartán y losartán: las marcadas diferencias entre sus propiedades químicas y farmacológicas pueden explicar la diferencia en la eficacia terapéutica en pacientes hospitalizados con covid-19
Dres Rodolfo Pedro Rothlin,1 Facundo Germán Pelorosso,2 Mariano Duarte,3,4 Liliana Nicolosi,5 Ignacio Eloy Fernandez Criado,6 María Victoria Salgado,7,8 Héctor Vetulli9
1 Sociedad Argentina de Farmacología Clínica, Asociación Médica Argentina, Argentina. 2 Servicio de Anatomía Patológica, Hospital de Alta Complejidad El Calafate SAMIC, Argentina. 3 Laboratorio de Hipertensión, División de Cardiología, Hospital de Clínicas “José de San Martín”, Facultad de Medicina, Universidad de Buenos Aires, Argentina. 4 Segunda Cátedra de Fisiología, Facultad de Medicina, Universidad de Buenos Aires, Argentina. 5 División de Cardiología, Hospital Español de Buenos Aires, Argentina. 6 Sección de Tecnología Educativa e Informática Médica, Hospital de Clínicas “José de San Martín”, Facultad de Medicina, Universidad de Buenos Aires, Argentina. 7 Centro de Estudios de Estado y Sociedad, Ciudad Autónoma de Buenos Aires, Argentina. 8 Servicio de Medicina Familiar, Hospital de Alta Complejidad El Calafate SAMIC, Argentina. 9 Servicio de Electrofisiología Cardíaca, Arritmias y Marcapasos, Sanatorio Otamendi y Miroli, Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
El objetivo de este artículo es comparar las propiedades químicas y farmacológicas del telmisartán y el losartán, y su metabolito activo EXP3174, con el fin de entender por qué el telmisartán es efectivo en pacientes hospitalizados con covid-19 mientras que el losartán no lo es. Se llevó a cabo una revisión bibliográfica exhaustiva de las propiedades químicas, farmacocinéticas y farmacodinámicas de ambos fármacos y se destacaron las diferencias más importantes que podrían estar relacionadas con su efectividad en pacientes con covid-19. Se concluyó que las propiedades farmacológicas del telmisartán, como su mayor afinidad por el receptor AT1, su duración de acción prolongada y su capacidad para modular la inflamación podrían explicar su efectividad en pacientes con covid-19. Por otro lado, las propiedades farmacológicas del losartán, como su menor afinidad por el receptor AT1 y su rápido metabolismo, pueden limitar su efectividad en pacientes con covid-19. Estos resultados resaltan la importancia de comprender las propiedades químicas y farmacológicas de los medicamentos para identificar posibles candidatos terapéuticos efectivos en el tratamiento de covid-19.
Palabras claves. Telmisartan, losartan, Covid-19, ECA.
Telmisartan and Losartan: Marked Differences in Chemical and Pharmacological Properties May Explain Differences in Therapeutic Efficacy in Hospitalized Patients with COVID-19
Summary
The objective of this article is to compare the chemical and pharmacological properties of telmisartan and losartan and their active metabolite EXP3174 to understand why telmisartan is effective in hospitalized patients with COVID-19 while losartan is not. A comprehensive literature review of the chemical, pharmacokinetic and pharmacodynamic properties of both drugs was done to highlight the most important differences that may be related to their efficacy in patients with COVID-19. It was concluded that the pharmacological properties of telmisartan, such as its higher affinity for the AT1 receptor, its long duration of action and its ability to modulate inflammation, could explain its efficacy in patients with COVID-19. On the other hand, the pharmacological properties of losartan, such as its lower affinity for the AT1 receptor and its rapid metabolism, may limit its efficacy in patients with COVID-19. These results highlight the importance of understanding the chemical and pharmacological properties of drugs to identify potential effective therapeutic candidates for the treatment of COVID-19.
Keywords. Telmisartan, losartan, Covid-19, ACE.
Introducción
Al comienzo de la pandemia de covid-19, Gurwitz,1 teniendo en cuenta que el virus SARSCoV-2 entra en las células después de unirse a ACE2 (enzima convertidora de angiotensina),2 propuso la hipótesis de la participación del sistema RAS (sistema renina angiotensina) en la fisiopatología de esta enfermedad. Nuestra adhesión a la hipótesis llevó al diseño de un ensayo clínico que seleccionó el telmisartán entre los bloqueadores de los receptores de angiotensina AT1 (ARB), a una dosis de 80 mg dos veces al día, por vía oral, durante 14 días, para el tratamiento de pacientes hospitalizados con covid-19.2 Por otro lado, también a partir de abril de 2020, se diseñó un ensayo clínico con losartán, otro ARB, en pacientes hospitalizados con covid-19, administrando una dosis de 50 mg por vía oral, dos veces al día durante 10 días (NCT04312009). Recientemente, Liu et al.3 publicaron los resultados obtenidos después de analizar 54 ensayos clínicos aleatorizados (ECA) que compararon 13 fármacos para el tratamiento de pacientes con covid-19 frente a placebo o tratamiento estándar. Entre los fármacos seleccionados para el análisis se incluyeron dos ARBs, el telmisartán y el losartán. Para evaluar la eficacia de los fármacos incluidos, se evaluaron todas las causas de mortalidad a 5-8, 14/15, 21-, 25-, 28/30, 35-, 45-, 60-, 70 y 90 días.
En comparación con el grupo de control, solo cuatro fármacos mostraron una eficacia estadísticamente significativa en la reducción de la mortalidad. Entre estos cuatro fármacos, se destaca el antagonista del receptor AT1 de angiotensina II, el telmisartán, que mostró una reducción del 81% en el riesgo de mortalidad a los 30 días luego de la administración oral en dosis de 80 mg, dos veces al día durante 14 días, y en pacientes hospitalizados con covid-19 no admitidos en una unidad de cuidados intensivos y no más de 4 días después del inicio de los síntomas.4 Por el contrario, el losartán no mostró eficacia oral a una dosis de 50 mg dos veces al día durante 10 días en pacientes hospitalizados con covid-19.5
Por otro lado, un artículo reciente6 informó los resultados de un ensayo clínico aleatorizado del tratamiento con telmisartán en pacientes con covid-19. Este estudio se llevó a cabo principalmente en India (el 99% de todos los sujetos) durante el período comprendido entre el 3 de mayo y el 13 de noviembre de 2020, cuando estaba presente la variante delta del SARS-CoV-2. El telmisartán (40 mg al día) no logró reducir la mortalidad. Solo el 24% de todos los sujetos tenían > 60 años (edad media de 49 años) y solo el 3% tenía enfermedad cardiovascular subyacente. El ensayo se detuvo después de 14 días, debido a la futilidad. Las tasas de mortalidad generales fueron solo de 10/368 (2,72%) en el grupo de telmisartán y 6/378 (1,58%) en el grupo de placebo. Los resultados del ensayo tienen un impacto bajo tanto para la práctica clínica como para la evaluación del papel del bloqueo del RAS en covid-19, teniendo en cuenta que los participantes del estudio eran relativamente jóvenes, la gravedad de la enfermedad y la mortalidad eran bajas, y la dosis de telmisartán utilizada fue cuatro veces menor que las dosis efectivas previamente descritas en pacientes hospitalizados con covid-19.4 En línea con la falta de efectividad clínica del telmisartán 40 mg/día, se encuentran los resultados obtenidos por Bähr et al., 7 en los cuales solo el tratamiento con dosis alta (160 mg/día) de telmisartán induce genes diana del receptor gamma activado por el proliferador de peroxisomas (PPARgamma) en monocíticos de pacientes con síndrome metabólico.
Estos resultados han planteado una gran pregunta en la comunidad científica internacional acerca de por qué entre dos fármacos del mismo grupo farmacológico (ARBs) utilizados en dosis equivalentes como antihipertensivos, se observa que uno de ellos (telmisartán) es efectivo y que el otro (losartán) no lo es en pacientes hospitalizados con covid-19.8-11 El objetivo de este manuscrito es comparar las propiedades químicas y farmacológicas del telmisartán y el losartán, las cuales, debido a sus marcadas diferencias, respaldan los resultados obtenidos con la administración de ambos agentes en pacientes hospitalizados con covid-19. La Tabla 1 muestra las principales propiedades químicas, farmacocinéticas y farmacodinámicas del telmisartán, el losartán y su metabolito activo EXP3174. Además, se realiza un análisis comparativo entre estos bloqueadores de los receptores de angiotensina AT1, indicando las diferencias más importantes entre ellos, que consideramos relacionadas con la efectividad del telmisartán, por un lado, y la falta de efectividad del losartán, por el otro, en pacientes hospitalizados con covid-19.
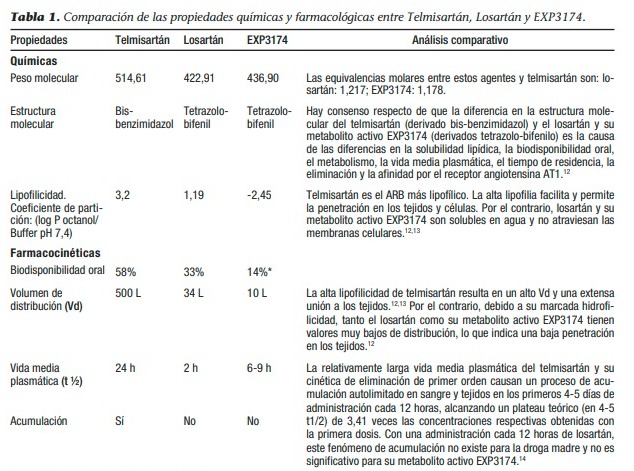
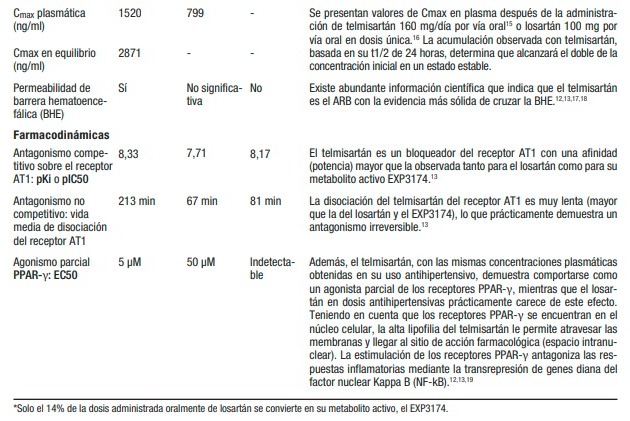
Sitio de acción farmacológica de telmisartán y losartán
La principal acción farmacológica tanto del telmisartán como del losartán es el bloqueo de los receptores AT1 de la angiotensina II. Los receptores AT1 son receptores de la membrana celular con una estructura de siete dominios transmembranales. Por lo tanto, para desarrollar la mencionada acción farmacológica, cada uno de los ARB debe llegar al llamado sitio de acción farmacológica o biofase, representado por el espacio extracelular en contacto íntimo con los receptores AT1. Para ejercer su efecto antihipertensivo, el telmisartán y el losartán alcanzan concentraciones en la biofase (espacio extracelular en contacto con las células musculares lisas arteriales) farmacológicamente efectivas para contrarrestar la sobreestimulación de los receptores AT1 causada por la angiotensina II endógena (la Tabla 1 muestra la Cmax del telmisartán y el losartán en dosis orales de 160 mg y 100 mg, respectivamente, que son mayores que los valores de pKi o pIC50 como bloqueadores de los receptores AT1). El virus SARS-CoV-2 ingresa a las vías respiratorias y se une, mediante la proteína S en su superficie, a la proteína de membrana ACE2 en las células alveolares de tipo 2.
El complejo proteína S-ACE2 se internaliza por endocitosis, facilitando la entrada de cada virión al citoplasma. La consecuencia es una pérdida parcial o total de la función ACE2 en las células alveolares del pulmón en relación directa con la carga viral del inóculo de aire. La función de ACE2 es catalizar la transformación de angiotensina II en su antagonista fisiológico angiotensina 1-7 (actuando sobre los receptores Mas causa vasodilatación y efectos antiinflamatorios). La infección con el virus SARS-CoV-2 produce una desviación del equilibrio homeostático del sistema renina-angiotensina a favor del eje angiotensina II-receptor AT1, promoviendo efectos proinflamatorios.2 Por otro lado, se ha demostrado en cultivos celulares de Neuro-2A (una línea celular de neuroblastoma murino) que la estimulación del receptor AT1 puede facilitar la internalización de ACE2 y la degradación lisosomal, probablemente debido a la coendocitosis de ambas proteínas durante la internalización del receptor AT1 mediado por la angiotensina II. Además, este efecto fue inhibido por el bloqueador del receptor AT1, losartán.20 Por lo tanto, la administración de un bloqueador del receptor AT1 en pacientes con covid-19 podría dificultar la internalización relacionada con ACE2 del SARSCoV-2 en células infectadas, un efecto aditivo al bloqueo de los receptores AT1 que antagoniza los efectos proinflamatorios de la angiotensina II.21 Además, recientemente, Piplani et al., 22 basados en los resultados obtenidos con telmisartán utilizando un protocolo de acoplamiento in silico y dinámica molecular validado efectivo para identificar fármacos contra el SARS-CoV-2 capaces de unirse a la espiga, especulan que la efectividad clínica del telmisartán en nuestro ensayo clínico en pacientes con covid-19 puede deberse a su acción bloqueadora en el cambio conformacional requerido para que la espiga se una a ACE-2. Existe una amplia evidencia científica de que los macrófagos pulmonares poseen todos los componentes de un sistema RAS celular.23,24 También existe información fisiopatológica sólida que implica a los macrófagos alveolares pulmonares en el desarrollo del proceso inflamatorio de covid-19 después de que cantidades significativas de SARS-CoV-2 llegan a los alvéolos y su captación por estas células induce fenotipos proinflamatorios.25 Por lo tanto, el sitio de acción farmacológica de ambos ARB, para obtener un efecto antiinflamatorio pulmonar en pacientes con covid-19, es el espacio extracelular que rodea a los macrófagos pulmonares en contacto íntimo con los receptores AT1.
Conclusión
Si el proceso inflamatorio a nivel pulmonar sufrido por pacientes con covid-19 depende significativamente de la sobreestimulación de los receptores AT1 de los macrófagos pulmonares, la efectividad clínica que puede obtenerse con la administración de un ARB como el telmisartán o el losartán requiere que alcancen concentraciones efectivas en la biofase (en el espacio extracelular en contacto íntimo con los receptores AT1). El análisis comparativo de las principales propiedades químicas y farmacológicas de estos dos fármacos (Tabla 1) nos permite predecir que, administrados en dosis equivalentes para el tratamiento de la hipertensión, el telmisartán, al penetrar el intersticio pulmonar, alcanzará concentraciones efectivas en el tejido pulmonar que respalden la efectividad obtenida con el telmisartán,4 y podría explicar la falta de efectividad con el losartán5 en pacientes hospitalizados con covid-19. Muchos estudios han demostrado que el uso de inhibidores de la ECA/ARB se asocia con una reducción de la mortalidad en los pacientes con covid-19.26-33 Teniendo en cuenta que el telmisartán es un ARB muy seguro (incluso en dosis altas presenta efectos adversos similares al placebo), barato y disponible prácticamente en todo el mundo, puede representar una herramienta terapéutica off-label en pacientes con covid-19, en especial en países con pocos recursos, para enfrentar las actuales y futuras oleadas de SARS-CoV-2.
Bibliografía
1. Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug Dev Res. 2020;81(5):537- 40. DOI:10.1002/DDR.21656
2. Rothlin RP, Vetulli HM, Duarte M, Pelorosso FG. Telmisartan as tentative angiotensin receptor blocker therapeutic for COVID-19. Drug Dev Res. 2020;81(7):768-70. DOI:10.1002/DDR.21679
3. Liu D, Wu P, Gu W, et al. Potential of angiotensin II receptor blocker telmisartan in reducing mortality among hospitalized patients with COVID-19 compared with recommended drugs. Cell Discov. 2022;8(1). DOI:10.1038/ S41421-022-00454-7
4. Duarte M, Pelorosso F, Nicolosi LN, et al. Telmisartan for treatment of Covid-19 patients: An open multicenter randomized clinical trial. EClinicalMedicine. 2021;37. DOI:10.1016/j.eclinm.2021.100962
5. Puskarich MA, Ingraham NE, Merck LH, et al. Efficacy of Losartan in Hospitalized Patients With COVID-19-Induced Lung Injury: A Randomized Clinical Trial. JAMA Netw Open. 2022;5(3):e222735-e222735. DOI:10.1001/ JAMANETWORKOPEN.2022.2735
6. Jardine MJ, Kotwal SS, Bassi A, et al. Angiotensin receptor blockers for the treatment of covid-19: pragmatic, adaptive, multicentre, phase 3, randomised controlled trial. BMJ. 2022;379:e072175. DOI:10.1136/bmj-2022-072175
7. Bähr I-N, Tretter P, Krüger J, et al. High-Dose Treatment With Telmisartan Induces Monocytic Peroxisome Proliferator-Activated Receptor-γ Target Genes in Patients With the Metabolic Syndrome. Hypertension. 2011;58(4):725- 32. DOI:10.1161/HYPERTENSIONAHA.111.173542
8. Tsampasian V, Corballis N, Vassiliou VS. Renin-Angiotensin-Aldosterone Inhibitors and COVID-19 Infection. Curr Hypertens Rep. 2022;24(10):425-33. DOI:10.1007/ s11906-022-01207-3
9. Kow CS, Ramachandram DS, Hasan SS. Effects of Angiotensin II Receptor Blockers on the Risk of Mortality in Patients with COVID-19: An Updated Systematic Review and Meta-analysis of Randomized Trials. Am J Hypertens. 2022;35(8):763-4. DOI:10.1093/ajh/hpac070
10. Theodorakopoulou MP, Alexandrou M-E, Boutou AK, Ferro CJ, Ortiz A, Sarafidis P. Renin-angiotensin system blockers during the COVID-19 pandemic: an update for patients with hypertension and chronic kidney disease. Clin Kidney J. 2022;15(3):397-406. DOI:10.1093/ckj/sfab272
11. Gonçalves J, Santos CD, Fresco P, Fernandez-Llimos F. Potential use of renin-angiotensin-aldosterone system inhibitors to reduce COVID-19 severity. Rev Port Cardiol. Marzo de 2023. DOI:10.1016/J.REPC.2022.02.014
12. Burnier M. Telmisartan: A different angiotensin II receptor blocker protecting a different population? J Int Med Res. 2009;37(6):1662-79. DOI:10.1177/147323000903700602
13. Michel MC, Foster C, Brunner HR, Liu L. A systematic comparison of the properties of clinically used angiotensin II type 1 receptor antagonists. Pharmacol Rev. 2013;65(2):809-48. DOI:10.1124/pr.112.007278
14. Brocks DR, Mehvar R. Rate and extent of drug accumulation after multiple dosing revisited. Clin Pharmacokinet. 2010;49(7):421-38. DOI:10.2165/11531190-000000000-00000
15. Stangier J, Su CAPF, Roth W. Pharmacokinetics of orally and intravenously administered telmisartan in healthy young and elderly volunteers and in hypertensive patients. J Int Med Res. 2000;28(4):149-67. DOI:10.1177/147323000002800401
16. Das AK, Dhanure S, Savalia AK, Nayak SK, Tripathy SK. Human bioequivalence evaluation of two losartan potassium tablets under fasting conditions. Indian J Pharm Sci. 2015;77(2):190-5. DOI:10.4103/0250-474x.156583
17. Noda A, Fushiki H, Murakami Y, et al. Brain penetration of telmisartan, a unique centrally acting angiotensin II type 1 receptor blocker, studied by PET in conscious rhesus macaques. Nucl Med Biol. 2012;39(8):1232-5. DOI:10.1016/J.NUCMEDBIO.2012.06.012
18. Petek B, Villa-Lopez M, Loera-Valencia R, et al. Connecting the brain cholesterol and renin–angiotensin systems: potential role of statins and RAS-modifying medications in dementia. J Intern Med. 2018;284(6):620-42. DOI:10.1111/joim.12838
19. Pascual G, Fong AL, Ogawa S, et al. A SUMOylationdependent pathway mediates transrepression of inflammatory response genes by PPAR-γ. Nature. 2005;437(7059):759-63. DOI:10.1038/nature03988
20. Deshotels MR, Xia H, Sriramula S, Lazartigues E, Filipeanu CM. Angiotensin II mediates angiotensin converting enzyme type 2 internalization and degradation through an angiotensin II type I receptor-dependent mechanism. Hypertens (Dallas, Tex 1979). 2014;64(6):1368- 75. DOI:10.1161/HYPERTENSIONAHA.114.03743
21. Offringa A, Montijn R, Singh S, Paul M, Pinto YM, PintoSietsma S-J. The mechanistic overview of SARS-CoV-2 using angiotensin-converting enzyme 2 to enter the cell for replication: possible treatment options related to the reninangiotensin system. Eur Hear journal Cardiovasc Pharmacother. 2020;6(5):317-25. DOI:10.1093/ehjcvp/pvaa053
22. Piplani S, Singh PK, Winkler DA, Petrovsky N. In silico comparison of SARS-CoV-2 spike protein-ACE2 binding affinities across species and implications for virus origin. Sci Rep. 2021;11(1):13063. DOI:10.1038/s41598-021-92388-5
23. Bullock GR, Steyaert I, Bilbe G, et al. Distribution of type-1 and type-2 angiotensin receptors in the normal human lung and in lungs from patients with chronic obstructive pulmonary disease. Histochem Cell Biol. 2001;115(2):117-24. DOI:10.1007/S004180000235
24.Verdecchia P, Cavallini C, Spanevello A, Angeli F. The pivotal link between ACE2 deficiency and SARS-CoV-2 infection. Eur J Intern Med. 2020;76:14-20. DOI:10.1016/J. EJIM.2020.04.037
25. Dockrell DH, Russell CD, McHugh B, Fraser R. Does autonomous macrophage-driven inflammation promote alveolar damage in COVID-19? Eur Respir J. Agosto de 2022:2201521. DOI:10.1183/13993003.01521-2022
26. Spannella F, Giulietti F, Di Pentima C, et al. Renin-Angiotensin-System Inhibitors Are Associated With Lower In-hospital Mortality in COVID-19 Patients Aged 80 and Older. Front Cardiovasc Med. 2022;9:916509. DOI:10.3389/fcvm.2022.916509
27. Baral R, Tsampasian V, Debski M, et al. Association Between Renin-Angiotensin-Aldosterone System Inhibitors and Clinical Outcomes in Patients With COVID-19: A Systematic Review and Meta-analysis. JAMA Netw open. 2021;4(3):e213594. DOI:10.1001/jamanetworkopen.2021.3594
28. Lam KW, Chow KW, Vo J, et al. Continued In-Hospital Angiotensin-Converting Enzyme Inhibitor and Angiotensin II Receptor Blocker Use in Hypertensive COVID-19 Patients Is Associated With Positive Clinical Outcome. J Infect Dis. 2020;222(8):1256-1264. DOI:10.1093/infdis/jiaa447
29. Zhang P, Zhu L, Cai J, et al. Association of Inpatient Use of Angiotensin Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers with Mortality Among Patients With Hypertension Hospitalized With COVID-19. Circ Res. Abril de 2020:CIRCRESAHA.120.317134. DOI:10.1161/CIRCRESAHA.120.317134
30. Zhang G, Wu Y, Xu R, Du X. Effects of renin-angiotensinaldosterone system inhibitors on disease severity and mortality in patients with COVID-19: A meta-analysis. J Med Virol. 2021;93(4):2287-300. DOI:10.1002/ jmv.26695
31.Wang H-Y, Peng S, Ye Z, et al. Renin-angiotensin system inhibitor is associated with the reduced risk of all-cause mortality in COVID-19 among patients with/ without hypertension. Front Med. 2022;16(1):102-10. DOI:10.1007/s11684-021-0850-9
32.Wang Y, Chen B, Li Y, et al. The use of renin–angiotensin–aldosterone system (RAAS) inhibitors is associated with a lower risk of mortality in hypertensive COVID-19 patients: A systematic review and meta-analysis. J Med Virol. 2021;93(3):1370-7. DOI: https://doi.org/10.1002/ jmv.26625
33. Rizk JG, Wenziger C, Tran D, et al. Angiotensin-Converting Enzyme Inhibitor and Angiotensin Receptor Blocker Use Associated with Reduced Mortality and Other Disease Outcomes in US Veterans with COVID-19. Drugs. 2022;82(1):43-54. DOI:10.1007/s40265-021-01639-2
Descargar Contenido
ACTUALIZACIÓN
Confundibilidad marcaria en los productos farmacéuticos
Dra Mariela Borgarello
Abogada, Facultad de Derecho de la Universidad de Buenos Aires (UBA). Diplomatura en Seguridad del Paciente y Calidad de Atención Sanitaria de la Facultad de Ciencias Biomédicas de la Universidad Austral. Docente e Investigadora de la Maestría en Propiedad Intelectual (MPI) de la Facultad Latinoamericana de Ciencias Sociales (FLACSO). Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
Se describe una visión multidisciplinaria del problema de confundibilidad de las marcas en los productos farmacéuticos y su repercusión en la salud de la población. Expresan sus opiniones expertos de distintos países, que fueron convocados por la Facultad Latinoamericana de Ciencias Sociales (FLACSO) en un conversatorio realizado en octubre de 2022. Se tratan diversos aspectos: a) el riesgo de confusión en la identificación del producto farmacéutico, b) el registro de marcas farmacéuticas en Brasil y a nivel europeo, c) los medicamentos LASA y los riesgos de similitudes de fonética y grafía, d) el examen de patentes de invención y el estudio de marcas de productos farmacéuticos. Todo ello en el marco de su relación con la seguridad del paciente.
Palabras claves. Marcas farmacéuticas, capacidad distintiva, denominaciones comunes internacionales, impacto en la salud, seguridad del paciente.
Trademark confusion in pharmaceutical products
Summary
A multidisciplinary vision of the problem of confusion of brands in pharmaceutical products and its impact on the health of the population is described. Experts from different countries who were convened by the Latin American Faculty of Social Sciences (FLACSO) expressed their opinions in a discussion held in October 2022. Various aspects were discussed: a) the risk of confusion in the identification of the pharmaceutical product, b) the registration of pharmaceutical trademarks in Brazil and at a European level, c) LASA drugs and the risks of phonetic and spelling similarities, d) the examination of invention patents and the study of trademarks of pharmaceutical products. All this within the framework of its relationship with patient safety.
Keywords. Pharmaceutical brands, Distinctiveness, International nonproprietary names, Impact on health, Patient safety.
El 25 de octubre de 2022, en la sede de la Facultad Latinoamericana de Ciencias Sociales (FLACSO) de la Argentina, tuvo lugar el primer “Conversatorio sobre Confundibilidad de Marcas de Productos Farmacéuticos” (Figura 1).

Fue coordinado por la Dra. Mariela Borgarello y reunió a expertos internacionales, que disertaron por Zoom desde Brasil, Colombia y España, así como expertos nacionales, que lo hicieron de manera presencial. Ellos fueron: a) El Dr. Fredy Sánchez Merino: abogado, especialista en patentes y magíster en Gestión de la Propiedad Intelectual; director de Innovación de la Universidad Simón Bolívar de Colombia. También es autor de distintos trabajos sobre temas de propiedad intelectual.
b) El Dr. Eli Salis: licenciado en Derecho, Universidad Nacional del Litoral (UNL), Santa Fe, Argentina (1987-1992); máster en Propiedad Industrial e Intelectual y Sociedad de la Información, Universidad de Alicante, España (1994-1995), y fundador de DISAIN IP, con sede en Alicante, España.
c) El Dr. Luiz Augusto Lopes Paulino: grado y posgrado en Derecho por la Pontificia Universidad Católica de San Pablo, Brasil. Su actuación se destaca sobre todo en las áreas de litigio y litigio previo, incluyendo patentes y marcas, competencia desleal, derecho de autor y cuestiones reglamentarias. Es miembro de importantes asociaciones, como ABAPI y OAB-SP.
d) El Dr. Ricardo J. Losardo: médico y doctor en Medicina, Universidad de Buenos Aires (UBA); médico legista; profesor titular de la Escuela de Posgrado de la Facultad de Medicina de la Universidad del Salvador (USAL); Exdirector del Hospital de Oncología “Marie Curie” (GCBA) y presidente del Comité de Seguridad del Paciente de la Asociación Médica Argentina (AMA). También es autor de distintos trabajos sobre temas de seguridad del paciente.
e) El Lic. Eduardo Sanchirico: licenciado en Ciencias Químicas, Facultad de Ciencia y Tecnología de la Universidad del Salvador (USAL); jefe del Departamento Técnico Químico (Química Orgánica, Farmacia y Biotecnología) de la Administración Nacional de Patentes (desde el año 2013); docente invitado de la Maestría en Propiedad Intelectual (MPI) de la Facultad Latinoamericana de Ciencias Sociales (FLACSO) e investigador del Área Ética, Derecho y Bienes Públicos Globales.
El objetivo de esta reunión fue compartir la visión sobre la temática de confundibilidad y distintividad de las marcas de productos farmacéuticos, con un enfoque interdisciplinario pero centrado en su implicancia respecto del acceso seguro a la salud. A continuación, realizamos algunas consideraciones generales sobre el tema y un resumen de los principales contenidos de estas exposiciones, con el fin de difundirlas, a través de esta publicación,en el ámbito médico.
Denominaciones Comunes Internacionales (DCI)
Las Denominaciones Comunes Internacionales (DCI) o International Non-Proprietary Names (INN) son una creación de la Organización Mundial de la Salud (OMS), en vigencia desde el año 1953. Fueron creadas con el propósito de identificar sustancias farmacéuticas o ingredientes activos, con la particularidad de que cada DCI sea una denominación única que en todo el mundo se identifique como tal y que, al ser común a todos, no sea monopolizable individualmente, al encontrarse bajo el dominio público. A través de las DCI, la OMS asigna un nombre único para que cada sustancia sea conocida de ese modo. Nombre Genérico o No Comercial es un sinónimo de las DCI y se utilizan para identificar un medicamento. Según la OMS: “Las DCI son necesarias para una identificación clara, una prescripción y despacho de medicamentos seguros, y para la comunicación e intercambio de información entre profesionales de la salud”. “Mediante la asignación de un nombre internacional exclusivo a cada medicamento, la OMS contribuye a asegurar que la receta extendida en el extranjero corresponda a lo que el médico había prescrito en el lugar de residencia.” Dra. Margaret Chan (Exdirectora general de la OMS).
La triple identificación del producto farmacéutico y el riesgo de confusión
El Dr. Fredy Sánchez Merino se refirió a aspectos generales del tema y afirmó que las bases de un posible riesgo de confusión marcaria básicamente puede fundarse en prohibiciones de carácter relativo. Destacó que, en el caso de los productos farmacéuticos, existe una particularidad que reside en el hecho de que tienen múltiples denominaciones, por lo cual, para poder identificarlos en ámbitos muy especializados, puede utilizarse la nomenclatura química; en un ámbito más general, puede emplearse la DCI, y ya a nivel de público consumidor o de personas no relacionadas directamente con la industria, se utiliza entonces la marca para identificar el producto farmacéutico. El hecho de que este tipo de productos pueda ser identificado de tres maneras distintas triplica la posibilidad de confusión respecto de otros productos que simplemente tienen una marca comercial o un nombre genérico para su designación. Por lo cual, en este caso, el análisis de fondo que realice un examinador en la administración de la oficina de propiedad intelectual de cada país debe ser extremadamente cuidadoso. En cuanto a la prohibición que envuelve la utilización de las DCI, existe un doble matiz. El de la típica prohibición relativa que proscribe el uso de marcas similares o idénticas, lo cual es bastante común en todas las legislaciones.
Esto puede ser aplicado con respecto a otras marcas y también con respecto a las DCI, porque estas pasan a ser la denominación común del producto. Y así como no es posible identificar marcas con el nombre genérico de los productos o servicios, lo mismo sucedería con las DCI. Solamente que, en este caso, no se estaría hablando de una prohibición de carácter relativo, sino de carácter absoluto. De manera que, a nivel legislativo, en materia de propiedad intelectual es muy común que todas las legislaciones o casi todas tengan un “filtro” en cuanto a la utilización de las DCI, tanto por la vía de la “prohibición relativa” como por la vía de la “prohibición absoluta” de registro. La prohibición se fundamenta en tres motivos, observados de manera muy general. El primero es que la DCI, al ser una indicación genérica para identificar el producto, debe estar disponible además de manera gratuita. Por lo tanto, no puede ser apropiada por un tercero, sobre todo con fines de lucro. En segundo lugar, hay partículas comunes que son comunes –valga la reiteración– a distintos tipos de medicamentos que no implican necesariamente la misma raíz farmacológica. Entonces, la utilización de estas partículas puede dar lugar no solo a la confusión de un medicamento con otro, sino con un medicamento que no necesariamente va a tener el efecto que persigue el consumidor final. Y, finalmente, desde un punto de vista estrictamente marcario, la posibilidad incrementada por todos estos factores de riesgo de confusión, lo cual no es deseable en una materia con posible impacto y consecuencias sobre la salud.
El registro de marcas farmacéuticas a nivel europeo
A continuación, el Dr. Eli Salis se centró en la experiencia de la Oficina de Propiedad Intelectual de la Unión Europea (UEIPO), en inglés European Union Intellectual Property Office (EUIPO), que se encarga del registro de marcas a nivel de la Unión Europea. Este afirmó que en la legislación europea de propiedad intelectual no hay una regulación especial en cuanto a marcas farmacéuticas. Una pequeña salvedad es que la UEIPO, al igual que muchas oficinas nacionales de países miembros de la Unión Europea, examina de oficio únicamente la concurrencia de prohibiciones absolutas (descriptividad), pero no lo hace con relación a prohibiciones relativas (confundibilidad), las cuales son estudiadas solo si media oposición de un tercero. Destacó, además, que a nivel europeo la jurisprudencia sobre confundibilidad de marcas de productos farmacéuticos no es homogénea, ya que no hay un criterio unívoco respecto de cuándo hay y cuándo no hay riesgo de confusión.
Hay una línea más permisiva, donde las decisiones de la UEIPO sostienen que con las marcas farmacéuticas se produce un menor índice de confusión, fundamentalmente porque están prescriptas por un profesional médico y se basan en una receta expedida por un facultativo. Sin embargo, frente a esa jurisprudencia permisiva, veamos que dicen las directrices (guidelines) de la UEIPO en relación con este tema. En primer lugar, a la hora de analizar productos farmacéuticos específicos que se consideran similares a otros productos farmacéuticos específicos. Esto es así, porque por regla general se cumplen allí todos los criterios de similitud. Por ejemplo, comparten la misma naturaleza porque son productos farmacéuticos específicos, el destino, que en sentido amplio es sanar o curar, los mismos lugares de venta, por ejemplo farmacias, y que, además, muchas veces proceden de la misma fuente: la industria farmacéutica. No obstante, el grado de similitud entre los productos farmacéuticos específicos puede variar en función de las indicaciones terapéuticas específicas. Esto significa que, cuanto más diferentes sean las funciones terapéuticas, menor va a ser el rigor con el que se va a analizar el riesgo de confusión. Otra cuestión importante que señalan las directrices de la UEIPO es que el hecho de que un determinado producto farmacéutico se venda con receta no es especialmente relevante al comparar los productos.
Por lo tanto, un medicamento con receta se considera similar a las medicinas de libre adquisición al momento de evaluar su similitud. Otro tema que trata la UEIPO es la confundibilidad entre los productos farmacéuticos y los productos cosméticos. En este caso, se llega a la conclusión de que, tratándose de “productos complementarios”, puede existir un determinado riesgo de confusión, porque además muchas veces se venden en los mismos lugares, el público destinatario mayoritariamente es el mismo, etc. También en muchas oportunidades lo fabrican las mismas empresas. Sin embargo, al comparar productos farmacéuticos específicos con cosméticos, se considera que hay un bajo grado de similitud, por lo cual hay que estar atento a cada caso en particular.
Entonces, teniendo en cuenta el carácter descriptivo que explicó Sánchez Merino de los códigos de las DCI y de las raíces, según las directrices de la UEIPO habría que plantearse una objeción frente a una marca en la Clase 5 (productos farmacéuticos) cuando la marca europea que se pretende registrar sea una DCI, aunque haya un error ortográfico y la pronunciación sea idéntica, y también cuando la DCI forme parte de una marca europea y esté acompañada de elementos no distintivos o descriptivos, como puede ser la palabra BIO, FARMA, CARDIO, y cuando la marca europea consista en solo una raíz. Sin embargo, hay que tener en cuenta que la práctica de la UEIPO es que determinadas marcas descriptivas o con ausencia de distintividad pueden acceder al registro si van acompañadas de una grafía o una parte figurativa que les dé distintividad; en este caso sí pueden ser registradas, evidentemente sin un monopolio sobre la DCI. Respecto de esto, hay que tener en cuenta que en la UEIPO no se pueden hacer disclaimers. Y el día que uno pretenda hacer valer esa marca en una acción judicial, seguramente va a ser el propio juez el que va a decidir que no existe monopolio sobre esa DCI.
Registro de marcas farmacéuticas en Brasil
El Dr. Luiz Augusto Lopes Paulino afirmó que, en el área de marcas farmacéuticas en Brasil, tenemos que prestar atención a dos agencias gubernamentales. La primera, es la Oficina de Marcas de Brasil (INPI), que registra todo tipo de marcas. La segunda es la Agencia Nacional de Vigilancia Sanitaria (ANVISA), que registra las marcas farmacéuticas. La importancia de lo expuesto reside en que los criterios de la Oficina de Marcas y los de la ANVISA no son exactamente iguales. Hay criterios iguales o parecidos, pero ANVISA tiene criterios adicionales. Por ejemplo, la Oficina de Marcas aplica por un lado los criterios de distintividad: la marca no puede ser un signo genérico, descriptivo, entre otras prohibiciones que determina la normativa. Cuando se quiere registrar un producto farmacéutico en ANVISA, debe tenerse en cuenta que este organismo tiene como propósito proteger a la población con relación a la salud. ANVISA examina también las marcas farmacéuticas y, más allá del examen de la Oficina de Marcas de Brasil, hace el suyo propio cuando se quiere registrar el producto. Según el artículo 15 de la Resolución ANVISA 59/2014 (Cuadro 1), existen criterios que deben cumplirse para registrar un producto farmacéutico y, consecuentemente, tener una marca farmacéutica registrada por ANVISA.
• Por ejemplo, la marca farmacéutica no puede tener el sufijo de la denominación común del producto.
• El producto farmacéutico no puede tener más del 50% del nombre de la sustancia activa del producto, es decir, la Denominación Común Brasilera.
• La designación, el signo de la marca farmacéutica, no tiene que corresponder a la forma farmacéutica del producto.
• No se puede tener una designación o marca que repita esa forma farmacéutica del producto.
• Tampoco se puede tener una designación o marca que refiera a un efecto superior o diferente sin comprobación. Si eso sucediese, el registro va a ser rechazado por ANVISA en función de la prohibición referida.
Entonces, en Brasil hay que tener mucho cuidado cuando se intenta registrar y comercializar una marca farmacéutica, dado que deben cumplirse los criterios de la Oficina de Marcas de Brasil (INPI) y los de ANVISA. El Dr. Lopes Paulino sostuvo asimismo que los tribunales tienen en cuenta el examen que realiza el INPI de Brasil y muestran diferentes enfoques cuando analizan los conflictos marcarios.

Una de las principales preocupaciones de los tribunales brasileños, además de la similitud fonética y gramática, es la posibilidad de confusión. Si hay posibilidad de confusión, el tribunal muy probablemente decidirá que la marca no puede convivir pacíficamente, porque la existencia de marcas farmacéuticas que causan confusión tiene como resultado una concurrencia desleal, el desvío de la clientela y, sobre todo, puede dar lugar a una confusión que afecta al paciente, lo cual es muy importante. Las marcas farmacéuticas examinadas por los tribunales brasileños se diferencian de otras marcas, en tanto que el examen es un poco distinto respecto de otras áreas o segmentos del comercio. En Brasil, por ejemplo, muchos de los medicamentos solo son comercializados con receta. Por lo tanto, la necesidad de una receta es un factor atenuante de la confusión. Dado que, si hay una receta y se va a la farmacia para comprar el medicamento, la posibilidad de confusión del medicamento es más baja. Otra cuestión que consideran los tribunales en Brasil es que los medicamentos vienen con un embalaje (trade dress). Eso es también un factor atenuante, a pesar de que las marcas no sean tan diferentes. Por último, el factor de que existiese una sustancia activa. Por lo tanto, si hay dos productos con marcas parecidas porque la sustancia activa es la misma, y la marca farmacéutica usa parte de la sustancia, prefijo o sufijo, eso es también un factor atenuante. Se puede tener la exclusividad sobre parte de la sustancia activa, porque eso, lejos de confundir, ayuda al consumidor a identificar el propósito del medicamento. Finalmente, el Dr. Lopes Paulino destacó que en Brasil se utilizan “Directrices de Examen de Marcas” que se aplican a todas las clases del Nomenclador Marcario Internacional (NMI).
La seguridad del paciente
El Dr. Ricardo Losardo felicitó a las autoridades de la FLACSO por vincular este aspecto de los medicamentos con un tema con el que en medicina se está trabajando ya desde hace un tiempo: la seguridad del paciente. Afirmó que el tema de confundibilidad marcaria en relación con los medicamentos está vinculado con el proceso de atención del paciente, dado que se trata de la confundibilidad de marcas: esto es, confusión, posibilidad de errar. Estos son problemas, riesgos que debemos evitar para proteger al paciente. La seguridad del paciente se ha instalado como un tema prioritario en la salud en todo el mundo y la Organización Mundial de la Salud (OMS) se ha involucrado a partir de este siglo XXI. Resulta ser no solo un imperativo médico, sino que abarca también lo social, lo científico, lo ético y lo legal. Es decir, abarca un gran campo, un amplio espectro, como expresamos habitualmente los médicos. Esta nueva disciplina necesita un enfoque multidisciplinario, por eso esta Jornada sobre Distintividad de Marcas Farmacéuticas reúne a abogados, químicos, médicos y profesionales de otras especialidades para el análisis y estudio de este tema que nos involucra a todos.
Vale la pena señalar cómo está evolucionando esta nueva disciplina de la seguridad del paciente. Actualmente, a menos de 20 años de que este tema empezara a ser tratado por la Organización Mundial de la Salud (OMS), ya se está estudiando como asignatura en algunas universidades en todo el mundo. Es decir, esta preocupación por la seguridad del paciente que abarca, como vemos, distintas áreas y profesiones, ha crecido a ritmo vertiginoso. A tal punto que se ha establecido un “Día Mundial de la Seguridad del Paciente” por parte de la Asamblea de la OMS en el año 2019, y el primer día en que se celebró fue el 17 de septiembre de 2020. Con esto se destaca la relevancia que ha adquirido esta temática. Repasando la historia, señalemos que en 1999 la Academia de Ciencias de los Estados Unidos emitió la publicación Errar es humano. A partir de allí, se empezaron a considerar muchos problemas, con el fin de que fueran subsanados de manera rápida. Pero este interés por la seguridad del paciente, que se inició con aquella publicación, no es nuevo. Ya en la época de Hipócrates se hablaba de “primero no dañar”, y en el Juramento Hipocrático de “hacer el bien”. Es decir, este tema está presente ya desde los albores de la medicina, cuando se realizaba una medicina primitiva que era una mezcla de magia, arte y ciencia. Pero ya existía el concepto de que había que actuar con “cierta seguridad” sobre el paciente, de tal manera que el objetivo que tiene esta nueva disciplina es prevenir y reducir los daños accidentales e involuntarios causados dentro de los sistemas de atención sanitaria. Por supuesto que si tratase de un daño intencional, estaríamos en otro terreno. La salud antes estaba circunscripta al médico y al paciente, eran solo dos personas. Adicionalmente, uno podía solicitar una radiografía y/o unos análisis, o algún otro estudio complementario que involucraba entonces a un tercero o a un cuarto personaje en la cadena de atención del paciente. Era un campo muy estrecho y se trataba solamente de un par de personas.
Actualmente, con el avance de la ciencia y de la tecnología, además de todo aquello que se va incorporando en este sistema de atención, el médico y el paciente aparecen pequeños. Sumado a esto, se ha desarrollado un amplio proceso en la atención, que además es dinámico y de cambio permanente. Hay numerosos actores involucrados en este proceso, muchos instrumentos y aparatos, así como también se presenta el tema de los medicamentos. En este variado contexto, las posibilidades de error se multiplican de manera importante. Entonces, surge la idea de advertir el riesgo de los incidentes o eventos adversos en la atención. De eso se trata la seguridad del paciente, de identificarlos, documentarlos y no ocultarlos. El objetivo es saber dónde está el error, subsanarlo y que no vuelva a repetirse. Lo que se ha escuchado en estas conferencias es que con el tema de las marcas de medicamentos tenemos problemas respecto de la confusión que pueden ocasionar de un producto con otro. Entonces tratemos de superarlo.
Es por eso que aquí se está tratando detalladamente el tema. Por supuesto, con el fin de lograr una mejor atención en la salud. La definición de la OMS dice: “La seguridad del paciente es la ausencia de un daño innecesario real o potencial, asociado a la atención sanitaria”. Con respecto al tema de las marcas de los medicamentos, hay que hacer una evaluación permanente de los riesgos y un aprendizaje a través de los errores, que en estas jornadas están siendo analizados. Es importante resaltar que hay productos farmacéuticos que se venden con receta, es decir, casos en los cuales hay una prescripción realizada por un facultativo, mientras que otros son de venta libre, o sea que no necesitan una receta médica. Recordemos que la OMS, en el año 2017, a través de la “Alianza Mundial para la Seguridad del Paciente”, lanzó su tercer reto: “Medicación sin daños”. El tema que tratamos hoy, que es evitar la confusión marcaria en los productos farmacéuticos, se incluye perfectamente en este tercer reto de la OMS. De esta manera, estas jornadas de FLACSO están contribuyendo al conocimiento y esclarecimiento de estos asuntos de preocupación mundial.
Medicamentos LASA: riesgos de similitudes de fonética y grafía
La Dra. Mariela Borgarello agregó que mientras que en el ámbito del Derecho de Propiedad Intelectual se alude a la temática de la confundibilidad en materia de productos farmacéuticos, en medicina se los denomina “medicamentos LASA”, aludiendo a la sílaba en inglés que sintetiza los términos “look alike sound alike”. Es decir, términos o palabras que se ven similares y suenan similares.En esta materia hay un importante trabajo que se desarrolla para evitar el error; se hacen listas de medicamentos y se trabaja activamente en la gestión médico-hospitalaria para separarlos y diferenciarlos adecuadamente. Existe un real reconocimiento del riesgo de confusión. Todo eso que se realiza a posteriori de que la marca es concedida, por la necesaria similitud que tienen ciertas sustancias químicas. En este sentido, sería muy interesante que esto también se tenga en cuenta en el ámbito de la propiedad intelectual, porque dentro de la temática de seguridad del paciente el daño con los medicamentos es uno de los importantes capítulos de esa disciplina, y la consigna es evitar o al menos minimizar los errores, tal como antes se destacó, porque, como lo hemos escuchado ya, en las distintas legislaciones esto aparece como una preocupación global.
Examen de patentes de invención y estudio de marcas de productos farmacéuticos
El Lic. Eduardo Sanchirico sostuvo que al discutir el paralelismo entre el examen de solicitudes de patentes del área química y el estudio de marcas de la clase 5 del NMI (productos farmacéuticos y otros productos para uso médico), más allá del diferente campo de propiedad intelectual de cada una de las solicitudes, encontramos que existe una relación entre ambas. Al comparar una solicitud de patentes con una de marcas, vemos que en estas últimas no se brinda demasiada información sobre el producto al cual se le va a aplicar la marca en cuestión. Contrariamente, en las “solicitudes de patentes”, la información brindada en la memoria descriptiva de la solicitud permite al examinador llevar a cabo una búsqueda de antecedentes del arte previo para decidir sobre la posibilidad de la concesión del derecho. En las “solicitudes de marcas” se expresa claramente cuál es el signo marcario y a qué tipo de producto se aplicará, así como la clase correspondiente, pero no se especifica claramente “qué contiene el producto”.
En el caso de las marcas farmacéuticas, por ejemplo, no suele explicarse cuál es el principio activo que tiene el producto sobre el que se utilizará la marca de la clase 5 del NMI. Una marca no puede ser descriptiva; por ende, dado que el nombre químico (IUPAC-Unión Internacional de Química Pura y Aplicada) y la DCI son meramente descriptivos, una marca no debe aludir a ellos. Esto es concordante con las recomendaciones de la OMS sobre la no utilización de las DCI como marcas. La OMS las considera de domino público y, por ende, no protegibles por marcas. Pero, además, las DCI son descriptivas. Volviendo a la comparación con las patentes y su forma de estudio, uno de los requisitos de patentabilidad es la actividad inventiva, que se define como “aquello que no se desprende de forma evidente del arte previo para una persona con conocimientos medios en la materia”. En virtud de esto, quien analiza este criterio debe ser un profesional. Dado que lo que para alguien sin conocimientos podría resultar no evidente, y por ende inventivo, para el profesional de dicha materia puede no serlo. Y si vamos al terreno de las marcas, decimos que estas no deben ser descriptivas y que no deben contener ni relacionarse con las DCI. Entonces, si una marca es analizada por alguien que no está familiarizado con lo que es una DCI, es posible que pueda considerar no descriptiva a una marca que sí lo es para quien reúne conocimientos en el campo farmacéutico.
El Lic. Sanchirico afirmó que se concluye, en consecuencia, que en el análisis registral de marcas farmacéuticas sería deseable que haya capacitación sobre los nombres genéricos o DCI para los analistas, o una supervisión de personal capacitado en dichos temas. Esto, además, sería consistente con la observancia de la jurisprudencia del Fuero Civil y Comercial Federal sobre la materia, que se ha expedido en el sentido que se refiriera precedentemente, por ejemplo, al no permitir que el término “IMATIB”, muy similar a la DCI “IMATINIB”, sea registrado como marca.
En tal sentido, se destaca que el 22 de febrero de 2019 la Sala I CCF se pronunció en la causa N° 803/2013 en autos caratulados “Laboratorios Aspen S.A. c/ Novartis A.G. s/ Cese de Oposición al Registro de Marca”, que confirmó la decisión de primera instancia y ,en consecuencia, sostuvo que la solicitud de la marca “IMATIB” por parte del Laboratorio Aspen S. A. para distinguir productos de la Clase 5 del NMI tenía un grado notable y relevante de similitud con la DCI “IMATINIB”, lo cual era contrario tanto a la Ley de Marcas N° 22.362, como también a la recomendación de la OMS a la que refirió Novartis A.G. al presentar su oposición en sede administrativa. Este último fundamento resultó novedoso en términos de preservar la seguridad de los pacientes, al evitar la apropiación particular de términos genéricos (DCI) o que sean muy similares a una DCI (Figura 2).

Conclusión
La función de los signos marcarios es su capacidad distintiva, permitiendo distinguir un producto farmacéutico de otro. Sin embargo, existen problemas de confundibilidad en algunos casos. Los requisitos de registros de las marcas comerciales presentan algunas debilidades y plantean amplias discusiones. La identidad del producto farmacéutico permite al paciente conocer su origen empresarial. Trabajar sobre la distintividad y la confundibilidad de productos farmacéuticos mejora el acceso seguro a la salud, reduce los daños causados al usuario y protege a la población en general. Todo lo expuesto confirma la importancia de los temas tratados en este “Conversatorio Internacional sobre Marcas de Productos Farmacéuticos”. Por otra parte, en la maestría en Propiedad Intelectual de FLACSO - Argentina, nos encontramos investigando este importante tema, cuyo debate continúa abierto a nivel nacional e internacional.
Bibliografía
1. Directrices sobre marcas y dibujos o modelos. EUIPO. Disponible en: https://guidelines.euipo.europa.eu/ 1935305/1991444/directrices-sobre-marcas/1-introduccion, acceso electrónico 12/12/2022.
2. ¿Qué es el trade dress y por qué es importante para la defensa de la PI en Brasil? LexLatin. Disponible en: https://lexlatin.com/reportajes/que-es-el-trade-dressdefensa-pi-brasil, acceso electrónico 12/12/2022.
3. Fredy Sánchez Merino. Marcas de Productos Farmacéuticos: un remedio para su regulación. Disponible en: https://revistas.uexternado.edu.co/index.php/propin/article/view/4159, acceso electrónico 14/03/2022.
4. Día Mundial de la Seguridad del Paciente. Argentina, Disponible en: https://www.argentina.gob.ar/noticias/dia-mundial-de-la-seguridad-del-paciente, acceso electrónico 12/12/2022.
5. La Ciudad se une a la campaña mundial por el Día de la Seguridad del Paciente iluminando monumentos de naranja. Buenos Aires. Disponible en: https://buenosaires.gob.ar/espaciopublicoehigieneurbana/noticias/la-ciudad-se-une-la-campana-mundial-por-el-dia-dela-seguridad
6. Rodríguez-Herrera R, Losardo RJ. Historia de la seguridad del paciente. Hitos principales, desde los albores de la civilización hasta los primeros retos globales y el estudio IBEAS. Revista de la Asociación Médica Argentina. 2018;131(4):25-30. Disponible en: https://www. ama-med.org.ar/uploads_archivos/1499/Rev-4-2018- Pag-25-30-Herrera.pdf, acceso electrónico 05/03/2023.
7. Confalone-Gregorián M, Bugna L, Calle G, y col.: Detección, análisis y prevención en el uso de medicamentos con similitud fonética, ortográfica o de envasado, en Argentina. Disponible en: http://www.epidemiologia.anm.edu.ar/wp-content/uploads/2017/ 11/Errores-de-medicacion_tipo_LASA.pdf, Acceso electrónico 12/12/2022.
8. Confusión y medicamentos: marcas farmacéuticas. Departamento de Propiedad Intelectual. Universidad Externado de Colombia. https://propintel.uexternado.edu.co/confusion-y-medicamentos-marcas-farmaceuticas/, acceso electrónico 28/02/2023.
9. La importancia del nombre. Organización Mundial de la Salud. Disponible en: https://www.who.int/es/newsroom/feature-stories/detail/what-s-in-a-name-, acceso electrónico: 12/12/2022.
10. Losardo R, Piantoni G, Mercau C, Buzzi A, Falasco S, Reilly J. Día Mundial de la Seguridad del Paciente: 17 de septiembre. Revista de la Asociación Médica Argentina. 2021;134(4):32-6. Disponible en: https:// www.ama-med.org.ar/uploads_archivos/2277/Rev-4 -2021_Pag-32-36_Dia-Mundial-del-Paciente_Losardoy-otros.pdf
Descargar Contenido
HISTORIA DE LA MEDICINA
Los presidentes médicos de la Sociedad Científica Argentina en sus 150 años
Dres Ricardo Jorge Losardo,1 Ángel Alonso2
1 Presidente de la Academia Panamericana de Historia de la Medicina. Miembro Honorario Nacional de la Asociación Médica Argentina (AMA). Integrante de la Comisión Directiva de la AMA. Profesor Titular de la Escuela de Posgrado de la Facultad de Medicina de la Universidad del Salvador (USAL). 2 Presidente de la Sociedad Científica Argentina (SCA) y director de los Anales de la SCA. Miembro titular de la Academia Nacional de Ciencias de Buenos Aires. Profesor Emérito de la Universidad de Buenos Aires (UBA). Miembro del Tribunal de Honor de la AMA y director de la Revista de la AMA. Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
Los autores describen los hechos que dieron lugar al nacimiento, en 1872, de la SCA, que cumplió 150 años de existencia. Se señalan sus fundadores, sus objetivos y los principales hitos a lo largo de ese tiempo. El análisis hace hincapié en que durante la primera mitad de ese período solo un presidente fue médico: los demás fueron ingenieros, físicos, químicos, militares, abogados e investigadores naturalistas. En cambio, durante la segunda mitad 8 médicos, de distintas especialidades, ocuparon la presidencia, todos con una destacada actuación profesional, tanto nacional como internacional, y que aportaron una característica especial a la institución, propia de esta profesión.
Palabras claves. Historia de la medicina, historia de la ciencia, médicos, ciencia, sociedades, Argentina.
The medical presidents of the Argentine Scientific Society in its 150 years
Summary
The authors describe the events that led to the birth, in 1872, of the SCA, which celebrated 150 years of existence. Its founders, its objectives and the main milestones throughout that time are indicated. The analysis emphasizes that during the first half of that period only one president was a doctor: the others were engineers, physicists, chemists, soldiers, lawyers, and naturalistic researchers. On the other hand, during the second half, 8 doctors, from different specialties, held the presidency, all with an outstanding professional performance, both nationally and internationally, and who contributed a special characteristic to the institution, typical of this profession.
Keywords. History of medicine, history of science, doctors, science, societies, Argentina.
Introducción
La Sociedad Científica Argentina (SCA), con 150 años de existencia, es una de las instituciones más representativas del país para el interés de la ciencia nacional e internacional (Figura 1).

Si bien no tenía laboratorios, la SCA fue creada con los objetivos de lograr una atmósfera que condujera a valorar la ciencia por parte de la sociedad de aquel entonces, y estimular a aquellos científicos pioneros. Además difundió sus trabajos a través de su publicación oficial, los Anales, demostrando que en la Argentina había un polo científico en desarrollo. El hecho fundacional se dio el 28 de julio de 1872. A partir de entonces la SCA se constituyó en impulsora de múltiples encuentros, viajes de estudios, promoción y realización de las primeras exposiciones científicas e industriales, sostén de las expediciones a puntos extremos del país, promotora de conferencias, seminarios y congresos. Estuvo siempre dispuesta a reunir a las más destacadas personalidades vinculadas a la ciencia y la cultura del país o de visita por él. También fue evaluadora de proyectos y asesora del Estado en temas puntuales de ciencia y técnica sometidos a su consideración. Es de destacar que en su momento la SCA financió el viaje y la manutención del conocido Perito Moreno (1852-1919), y de esta manera quedó asociada a nuestra soberanía patagónica. Intervino además en los estudios de los suelos magallánicos y la riqueza mineral de la cordillera de los Andes y de los esteros del Iberá. Años más tarde, participó de las campañas científicas a las islas Malvinas y a la Antártida. En 1878 la SCA patrocinó el Primer Congreso Científico Latinoamericano que fue un verdadero broche de oro para afianzar lo realizado en el último cuarto de siglo; y en 1910, el Congreso Científico Internacional Americano con motivo del Centenario de la Revolución de Mayo. Ambos eventos fueron respaldados desde la Presidencia de la Nación. En esa época eran pocos los organismos nacionales vinculados a la ciencia: un observatorio astronómico, la oficina meteorológica (luego Servicio Meteorológico Nacional), la Academia de Ciencia, dos universidades (Buenos Aires y Córdoba) y el Museo Público de Buenos Aires (luego Museo Nacional de Historia Natural). En la primera mitad de estos 150 años de existencia las principales actividades científicas que se llevaban a cabo en la SCA se referían a minería, geología, paleontología, etnografía, antropología, botánica, meteorología, etc. Es decir, casi con exclusividad, temas de ciencias naturales o ciencias puras, incluidas las matemáticas y algo de astronomía, física y química (se analizaban los suelos, flora y fauna). A partir de la presidencia del médico Gonzalo Bosch (1943-46), se incrementó la apertura hacia otros contenidos, como las ciencias médicas y la higiene urbana, así como las aguas (obras sanitarias). Orígenes y motivaciones La propuesta para crear una agrupación interesada por la ciencia partió de un grupo de jóvenes estudiantes universitarios residentes en Buenos Aires. Recordemos que por entonces el presidente del país era Domingo F. Sarmiento (1868-1874) y, si bien no tuvo injerencia directa en su creación, había una atmósfera cultural favorable para una decisión de este tenor. La actual Facultad de Ciencias Exactas, Físicas y Naturales, con varias carreras, concedió, en 1869, los primeros 12 títulos de ingenieros a: Valentín Balbín, Santiago Brian, Adolfo Buttner, Jorge Coquet, Luis A. Huergo, Francisco Lavalle, Carlos Olivera, Matías G. Sánchez, Luis Silveyra, Zacarías Tapia, Guillermo Villanueva y Guillermo White. Tres años después, algunos de ellos tuvieron una destacada actuación que permitió el inicio de la SCA, e incluso tres de ellos fueron presidentes en la primera década: Balbín, Huergo y White. De esta época fundacional no podemos olvidar dos hechos cronológicos importantes: El primero, protagonizado por los estudiantes del entonces Departamento de Ciencias Exactas, entre ellos Juan Dillón, Santiago Barabino, Luis A. Huergo, Valiente Noailles y Estanislao Zeballos, que habían pensado posibles denominaciones: unos se inclinaron por la de Academia Científica de Buenos Aires; otros, por la de Sociedad de Estímulo Científico, y así comenzaron a preparar un estatuto. En el segundo, y definitivo, ocurrido también a mitad de 1872 y tras una reunión realizada en el edificio del actual Colegio Nacional de Buenos Aires, se nombró una Comisión Directiva que tuvo como presidente a Luis A. Huergo; vicepresidente, a Augusto Ringuelet; secretario 1º, a Carlos Stegman; secretario 2º, a Juan Dillón; tesorero, a Ángel Silva y cuatro vocales: Guillermo White, Francisco Lavalle, Juan Remorino y Juan Revy. En esta convocatoria, que contó con una asistencia de 24 entusiastas universitarios, particularmente alumnos y profesores de la novel Facultad de Ciencias, se redactó el propósito que los guiaba, que fundamentalmente era promocionar: “Congresos y concursos científicos organizados por ella y su actuación en otros, que dieran en el exterior un mejor conocimiento del país, mientras se desempeñaba en conferencias y conversaciones científicas de múltiples aspectos; [y]… su Biblioteca Pública brinda el tesoro de las obras más notables”. Con esa concepción intelectual, el fervor adolescente y la racionabilidad creativa, nació la Sociedad Científica Argentina que hoy está cumpliendo 150 años de vida noble, activa y productiva (Figura 2).

Sedes de la SCA
La SCA funcionó al inicio en distintos lugares, pero finalmente tuvo dos sedes propias, ambas en la ciudad de Buenos Aires. La primera, en Virrey Cevallos 269, desde 1894 hasta 1934. Tenía un hermoso salón-auditorio que las fotografías de época han preservado para la memoria. Allí se escuchó a Alberto Einstein (premio Nobel de Física 1921) cuando visitó en 1925 nuestro país. La actual, desde 1934, en Avenida Santa Fe 1145, fue construida en un terreno donado por la entonces Municipalidad de la Capital Federal por 50 años; además, de una suma de dinero para su construcción aportada por el Congreso Nacional. Fue inaugurada cuatro años después. Tiene en la planta baja un salón de ingreso, bautizado Carlos Darwin (Figura 3), con bustos de Juan María Gutiérrez, Germán Burmeister, Luis A. Huergo y Florentino Ameghino (Figura 4), una estatua que rememora a Francisco P. Moreno y su desempeño en la cordillera de los Andes (Figura 5); y se suman varias placas recordatorias. Dispone de tres salones-aulas en la planta baja, denominados Luis F. Leloir, Estanislao Zeballos y Francisco P. Moreno. Una bella escalera de mármol –importado de Europa– lleva a los pisos superiores (Figura 6), donde se encuentran el Auditorio Florentino Ameghino (primer piso), con una capacidad para 200 personas y con confortables butacas de cuero en un ambiente renacentista, con un escenario importante, telón y piano de cola (Figura 7); y la Biblioteca Domingo Faustino Sarmiento (tercer piso), que pertenece a las denominadas Bibliotecas Públicas, y permite el libre acceso a los interesados. En el cuarto piso se encuentran oficinas para actividades administrativas, así como un aula para docencia universitaria o para encuentros laborales de gestión y organización ejecutiva. Estos pisos están comunicados también por un antiguo y clásico ascensor, centenario, que mantiene su aspecto original y funciona con seguridad por el mantenimiento constante durante todos estos años.





Expresidentes de la SCA
1872-1874, 1878-1879, 1881-1882: Ing. Luis A. Huergo
1874-1875, 1892-1893: Dr. Juan J. J. Kyle
1875-1877: Ing. Pedro Pico
1877-1878, 1883-1885: Ing. Guillermo White
1879-1880, 1887-1889: Dr. Valentín Balbín
1880-1881, 1882-1883: Dr. Carlos Berg
1885-1886: Ing. Luis A. Viglione
1886-1887: Dr. Estanislao Zeballos
1889-1891, 1895-1896, 1901-1902, 1904-1906, 1917-1919: Dr. Carlos María Morales
1891-1892: Ing. Eduardo Aguirre
1893-1894: Ing. Carlos Bunge
1894-1895: Ing. Miguel Iturbe
1896-1897: Dr. Ángel Gallardo
1897-1898: Ing. Domingo Nocetti
1898-1900: Ing. Marcial R. Candiotti
1900-1901: Dr. Manuel B. Bahía
1902-1903: Ing. Carlos Echagüe
1903-1904: Ing. Emilio Palacio
1906-1908: Gral. Ing. Arturo M. Lugones
1908-1909: Ing. Otto Krause
1909-1910, 1911-1912: Ing. Vicente Castro
1910-1911: Dr. Francisco P. Moreno
1912-1913: Gral. Dr. Agustín Álvarez
1913-1914, 1919-1923: Ing. Santiago E. Barabino
1914-1915: Dr. Francisco P. Lavalle
1915-1917, 1927-1929, 1933-1937: Ing. Nicolás Besio Moreno
1923-1927: Ing. Eduardo Huergo
1929-1933: Dr. Nicolás Lozano
1937-1943: Ing. Jorge W. Dobranich
1943-1946: Dr. Gonzalo Bosch
1946-1949: Ing. José M. Páez
1949-1951: Ing. Dr. Eduardo María Huergo
1951-1956: Dr. Abel Sánchez Díaz
1956-1959: Dr. Eduardo Braun Menéndez
1959-1962: Ing. Pedro Longhini
1962-1964: Dr. Pablo Negroni
1964-1970: Ing. José S. Gandolfo
1970-1976: Cap. de Navío Emilio L. Díaz
1976-1988: Ing. Agr. Eduardo Pous Peña
1988-1989: Ing. Augusto L. Blacqué
1989-1992: Ing. Lucio R. Ballester
1993-1999: Dr. Arturo Otaño Sahores
1999-2001: Dr. Andrés O. M. Stoppani
2001-2005: Dr. Alfredo G. Kohn Loncarica
2005-2009: Dr. Jorge R. A. Vanossi
2009-2013: Dr. Ángel Alonso
2013-2017: Dr. Eduardo A. Castro
2017-2021, 2021-actualidad: Dr. Ángel Alonso
Algunos socios reconocidos de la SCA
Destacamos algunos socios nacionales y extranjeros de la SCA, verdaderas personalidades que marcaron época y que tuvieron una activa participación, algunos de ellos fueron premios Nobel: Florentino Ameghino; José Babini; Valentín Balbín; Augusto Luis Bacqué; Santiago E. Barabino; Ángel Belluscio; Fortunato Benaim; Carlos Berg; Norman Borlaug; Alberto Boveris; Eduardo Braun Menéndez; Nicolás E. Breglia; Eugenio Bulygin; Mario Bunge; Germán Burmeister; Enrique Butty; Horacio H. Camacho; Horacio Capel Sáez; Vicente Castro; Enrique Chanourdie; Pedro Cattáneo; Mischa Cotlar; Alberto R. Dalla Via; Carlos Darwin; Alejandro De Nicola; Alberto Einstein; Bruno Ferrari Bono; Enrique Fermi; Ángel Gallardo; Diego Gracia Guillén; Benjamín A. Gould; Cristóbal M. Hicken; Eduardo L. Holmberg; Bernardo A. Houssay; Eduardo Huergo; Luis A. Huergo; Mario Isola; Guillermo Jaim Etcheverry; Guillermo Jáuregui; Agustín P. Justo; Otto Krause; Juan J. J. Kyle; Pedro Lain Entralgo; Luis Federico Leloir; César Lombroso; Per-Olov Löwdin; Guillermo Marconi; Joaquín D. Mendizábal y Tamborrel; César Milstein; Walter Nernst; José Luis Peset; Segundo V. Linares Quintana; Arturo Otaño Sahores; Rodolfo A. Phillippi; Eduardo A. Pigretti; George Porter; Guillermo Rawson; Manuel Sadosky; Abel Sánchez Díaz; Horacio José Sanguinetti; Luis A. Santaló; Alfredo Sordelli; Carlos L. Spegazzini; Eugenia Sacerdote de Lustig; Andrés O. M. Stoppani; Alberto C. Taquini; Fernando Tola Mendoza; Julio V. Uriburu; Pedro Visca; Selman A. Waksman; Gregorio Weinberg; Guillermo White; Estanislao Zeballos y Loris Zanatta.
Biblioteca
“Domingo Faustino Sarmiento” La biblioteca alberga 38.000 libros históricos, algunos de los cuales son incunables y están adecuadamente protegidos. Actualmente se estima el acervo en 75.000 libros y 5000 títulos de revistas. Ocupa una longitud equivalente a la del edificio (± 45 metros), sillones de la época restaurados, varias vitrinas con exposición de documentos y publicaciones históricas, así como mesas con iluminación propia para reuniones de comisiones o de trabajo (Figura 8).

Allí también se realizan conferencias, encuentros científicos y toda clase de actos académicos y culturales, que involucren por lo menos a 100 personas, ya que cuenta con un sistema para proyecciones audiovisuales de última generación. La biblioteca tiene una encargada, profesora de Historia y de Bibliotecología, que además participa en la organización y desarrollo de los eventos programados.
Publicaciones: Anales
En mayo de 1874, se publicó el primer número de los Anales Científicos Argentinos (que se mantuvo por cinco meses consecutivos), con la dirección de José María Ramos Mejía, Francisco Ramos Mejía y Estanislao Zeballos, con el objeto de que “contribuyan al progreso de la ciencia argentina”
En enero de 1876 comienzan a editarse los Anales de la Sociedad Científica Argentina (ASCA), que continúan publicándose actualmente. La primera comisión redactora estuvo integrada por: Pedro Pico, Estanislao S. Zeballos, Pedro N. Arata, Juan J. Kyle y Guillermo Villanueva. En el primer número se lee el siguiente texto: La República Argentina, con su Observatorio Astronómico, sus Oficinas Meteorológicas, su Academia de Ciencias, sus Universidades y su Museo de Buenos Aires, con su flora y su fauna aún desconocidas está obligada a llevar al mundo científico el contingente de luces que sólo ella puede proporcionar mientras que el comercial le reclama el resultado del estudio de sus grandes ríos navegables, el beneficio de sus inexploradas minas, de sus bosques y canteras y de cuantos tesoros en fin encierra su privilegiado y desconocido suelo. Al cumplirse el cincuentenario, el centenario y el sesquicentenario de la SCA, los Anales dedicaron una publicación homenaje sobre la investigación científica-histórica que abarcó cada uno de dichos períodos con diversos temas. Desde 1999, estas publicaciones están incluidas en la base de datos Latindex y en el Foro de Editores Científicos. La colección completa, que hasta la actualidad cuenta con 273 números, Indizada en Biodiversity Heritage Library, Smithsonian Institute (EE. UU.) y en Natural History Museum Library (R.U.) y en la Ernst Mayr Library de Harvard University (EE.UU.). Puede consultarse la versión digital en el sitio del Instituto Smithsoniano (EE.UU.): http://www.biodiversitylibrary.org/bibliography/44792#/summary o en la página Web de la revista: www.revistaanalessca.wordpress.com
Institutos de la SCA
En la SCA funcionaron varios institutos que reunieron a expertos en las respectivas temáticas, con el fin de constituir un polo de referencia a nivel nacional. Hoy en día funcionan los siguientes: Instituto de Geología “Sánchez Labrador”, Instituto de Comunicaciones Digitales, Instituto de Ciencia para la Innovación, Instituto de Historia de la Ciencia e Instituto de Ambiente.
Presidentes médicos de la SCA
Los 50 presidentes que tuvo la SCA en estos 150 años han sido: ingenieros, matemáticos, naturalistas, juristas, químicos, representantes de las fuerzas armadas, entre otros. Ocho de ellos fueron médicos: a continuación los citamos, con el período de su presidencia de la SCA, año de nacimiento y muerte, así como dedicación profesional. Todos ellos, además, fueron investigadores en sus respectivos campos profesionales y estuvieron vinculados a la Asociación Médica Argentina (AMA), cuya sede se encuentra en la misma cuadra:
1929-1933: Dr. Nicolás Lozano (1864-1938), médico salteño graduado en la UBA. Higienista reconocido por sus trabajos sobre el cólera y el paludismo.
Fue consejero y presidente de la Cruz Roja Argentina (prestigiosa entidad humanitaria en aquella época de guerra y paz). Autor del libro de La Cruz Roja Argentina. Tuvo una actuación destacada como funcionario de la Dirección Nacional de Higiene, entre ellas colaboró en “La habitación popular - Comisión Nacional de Casas Baratas” (Ley 9.677 del año 1936) (Figura 9).

1943-1946: Dr. Gonzalo Bosch (1885-1967). Su actividad asistencial estuvo siempre acompañada de la docencia y la investigación científica de las enfermedades mentales. Profesor titular de las cátedras de Psiquiatría de las facultades de Medicina de las universidades de Rosario y de Buenos Aires. Director del Hospicio de las Mercedes (actualmente Hospital Borda) y de la Colonia Nacional de Alienados “Domingo Cabred”. Fue un impulsor de la modernización de los manicomios, uno de los fundadores de la Academia Nacional de Ciencias de Buenos Aires y fundador de la Liga Argentina de Higiene Mental. Además, fue un escritor interesado en los temas sociales.
1956-1959: Dr. Eduardo Braun Menéndez (1903-1959), profesor titular de la cátedra de Fisiología de la Facultad de Medicina (UBA), uno de los discípulos preferidos de Bernardo Houssay, cuya investigación se centró principalmente en la fisiología cardiovascular (hipertensión arterial). Jefe de Electrocardiografía y Fisioterapia del Instituto Municipal de Radiología y Fisioterapia de Buenos Aires (actualmente Hospital de Oncología “María Curie”). Miembro de la Asociación Argentina para el Progreso de las Ciencias (AAPC) y de la Academia Nacional de Medicina de Buenos Aires. Fundador y director de la revista Ciencia e Investigación (AAPC). Director del Instituto de Biología y Medicina Experimental (IBYME). Publicó artículos en la revista de la AMA (Figura 10).
1962-1964: Dr. Pablo Negroni (1904-1992), destacado investigador pionero en micología. Jefe de Sección de Micología del Instituto Bacteriológico “Carlos Malbrán”. Profesor de la Cátedra de Microbiología de las Facultades de Veterinaria (UNLP) y de Medicina (UBA). Presidente de la Academia Nacional de Medicina (Buenos Aires). Miembro de la Academia de Ciencias Médicas de Córdoba, de la Academia Nacional de Ciencias de Córdoba y de la Asociación Argentina para el Progreso de las Ciencias (AAPC).
1992-1999: Dr. Arturo Otaño Sahores (1933- 2020), notable especialista en Ortopedia y Traumatología que se desempeñó en el Hospital de Clínicas (UBA), donde desarrolló novedosas técnicas quirúrgicas. También fue un apasionado historiador de la medicina, médico legista y cultor de la ética médica. Profesor titular de la Cátedra de Ortopedia y Traumatología de las Facultades de Medicina de la UBA y de la USAL Secretario de Estado de Ciencias y Tecnología del Ministerio de Cultura y Educación. Además fue Miembro de Honor de la AMA y publicó en la revista de esa entidad (Figura 11).

1999-2001: Dr. Andrés Oscar Manuel Stoppani (1915-2003), doctor en Medicina y en Química. Se inició como médico clínico en el Hospital de Clínicas (UBA ). Fue profesor titular de Química Biológica de las Facultades de Medicina (UBA y UNLP). También fue discípulo de Bernardo Houssay y un notable investigador en biología experimental. Presidente de la Academia Nacional de Medicina y de la Academia de Ciencias Exactas, Físicas y Naturales. Miembro de las Academias de Ciencias de Buenos Aires y de Córdoba. Director del CONICET. Presidente de la Asociación Argentina para el Progreso de las Ciencias (AAPC). Padrino de tesis del premio Nobel César Milstein. Publicó en la revista de la AMA.
2001-2005: Dr. Alfredo G. Kohn-Loncarica (1945-2005), profesor titular de Historia de la Medicina de la Facultad de Medicina (UBA), realizó importantes aportes originales en esta disciplina. Además, se desempeñó como secretario general del Consejo Directivo y director del Departamento de Humanidades Médicas de la Facultad de Medicina (UBA). Fue también médico legista, médico del trabajo y médico higienista. Recibió los premios AMA Eduardo Capdehourat (ética médica) y Guillermo Rawson (higiene). Integró el Comité de Redacción de la revista de la AMA. Fue Miembro de la Academia Nacional de Ciencias de Buenos Aires (Figura 12)

2009-2013 / 2017-2022: Dr. Ángel Alonso (n. 1938), profesor emérito y titular de la cátedra de Microbiología, Parasitología e Inmunología de la Facultad de Medicina (UBA). Exjefe de la división Alergia e Inmunología del Hospital de Clínicas (UBA). Director de la carrera de Especialistas en Alergia e Inmunología Clínica (UBA). También es médico legista.
Consideraciones finales
La ciencia y la técnica tienen una gran importancia para el desarrollo económico, social y cultural, así como la defensa de un país y su prosperidad general. Por ello siempre es necesaria la promoción de la ciencia y la tecnología -motivo de la creación y la existencia de la SCA- mediante la formación de recursos humanos, la realización de trabajos científicos y el equipamiento técnico indispensable para su realización. En su conducción, en la primera mitad de los 150 años, hubo un solo presidente médico. Esta profesión tuvo mayor presencia en la segunda mitad, cuando hubo siete de ellos que la presidieron por 31 años, lo que significa un 20% del tiempo de vida de la institución. Con estos ocho profesionales, y debido a su vocación médica y a sus cualidades de sensibilidad y compasión por el prójimo, se desarrollaron además los campos de las humanidades y la preocupación social en la SCA. Todos ellos tuvieron una gran hombría de bien y una inagotable capacidad de trabajo. Por otra parte, se ampliaron los temas publicados en los Anales, lo que permitió la difusión de trabajos con implicancias y repercusiones médicas.
Finalmente, la SCA en sus 150 años de existencia reunió a diversos científicos argentinos y extranjeros (incluso a premios Nobel) que dejaron enseñanzas sin egoísmos para ayudar al crecimiento sostenido del país. Destaquemos a dos de ellos: En abril de 1925, el físico Albert Einstein (premio Nobel 1921) disertó en el salón de la SCA de la calle Virrey Cevallos. Su visita vino precedida de 14 conferencias sobre la teoría de la relatividad, a cargo de destacados expositores. Fue designado socio honorario. En 1952, el médico Bernardo A. Houssay (premio Nobel 1947) escribió en el Libro de Oro de la SCA, con motivo del 80 aniversario de la institución: “Esta sociedad fue fundada por el amor a la ciencia, el idealismo y la fe en la patria de muchos buenos argentinos. Yo me he asociado a esta obra y las distinciones que he recibido han sido recompensas de esos esfuerzos de los que fueron, los que somos, los que van siendo y los que serán”. Además, dictó la conferencia titulada “El pasado y el futuro de la ciencia en Iberoamérica”.
Agradecimiento. Al Lic. José María Lentino, director administrativo de la SCA, por brindar las fotografías del edificio.
Bibliografía
1. Academia Nacional de Ciencias de Buenos Aires. La Academia, 80 años. https://web.archive.org/web/20160304194247/ http://www.ciencias.org.ar/listacategoriasproductos.asp?idCa tegory=796&tipo=0&urldes=&descurl=
2. Eduardo Braun Menéndez. FECIC. https://fecic.org.ar/eduardo-braun-menendez/
3. Hurtado-Hoyo, E.; Houssay, L.J.E.; Losardo, R.J.; Hurtado-Hoyo, E. (hijo); Van Tooren, J.A.: Homenaje al Dr. Bernardo Alberto Houssay (1887-1971). Sus vínculos con la Asociación Médica Argentina y con la educación en salud. A cincuenta años de su fallecimiento (primera parte). Revista de la Asociación Médica Argentina, 2022; 135 (1): 8-20.
4. Hurtado-Hoyo, E.; Houssay, L.J.E.; Losardo, R.J.; Hurtado-Hoyo, E. (hijo); Van Tooren, J.A.: Homenaje al Dr. Bernardo Alberto Houssay (1887-1971). Sus vínculos con la Asociación Médica Argentina y con la educación en salud. A cincuenta años de su fallecimiento (segunda parte). Revista de la Asociación Médica Argentina, 2022; 135 (2): 17-36.
5. Martí, M.L.: Academia Nacional de Medicina de Buenos Aires. Bicentenario 1822-2022. Prosa y Poesía Amerian Editores. 1° edición 2022, Buenos Aires.
6. Pablo Negroni. Fundación Konex. https://www.fundacionkonex.org/b538-pablo-negroni
7. Página Web de la Facultad de Medicina de la UBA. Galería de profesores. https://www.fmv-uba.org.ar/galeria-de-profesores/images/fotos_de_profesores/Stoppani_Andres_O.jpg
8. Página Web de la Sociedad Científica Argentina. http:// cientifica.org.ar/historia/
9. Página Web de los Anales de la SCA: www.revistaanalessca.wordpress.com
10. Página web de Wikipedia. Sociedad Científica Argentina https://es.wikipedia.org/wiki/Sociedad_Cient%C3%ADfica_ Argentina
11. Página Web Devoto Historia. Junta de Estudios históricos de Villa Devoto. Prof. Dr. Alfredo Guillermo Khon Loncarica https://devotohistoria.com.ar/articulos-de-revista-devoto-historia/profesor-dr-alfredo-guillermo-khon-loncarica/
12. Pérgola, F.: Historia de la medicina argentina. Editorial Eudeba. 1° edición 2014. Buenos Aires.
13. Sánchez, N.I.: La Sociedad Científica Argentina, 140 años de historia (salvaguarda de cinco valiosos congresos). Médicos y medicinas en la Historia N° 32: 5-17, 2013.
14. Sánchez, N.I.: 150 años de la Sociedad Científica Argentina (1872-2022), Anales de la Sociedad Científica Argentina, 2022; 273 (3): 3-18.
15. Silberman, F. S.: Arturo Otaño Sahores (1933-2020). Revista de la Asociación Argentina de Ortopedia y Traumatología, 2020. 85 (4): 451. https://raaot.org.ar/index.php/AAOTMAG/article/view/1205